| 幹細胞医学分野の研究概要 |
| 幹細胞医学分野の研究概要 |
| 概要 |
| 生体を構築する多くの組織や臓器の恒常性維持においては、幹細胞システムが大きな役割を果たしています。本研究分野では、幹細胞システムの動作原理の研究を通じて、生体組織の再生、老化、がん化の仕組みを理解し、臨床に応用すべく研究を行っています。組織幹細胞が幹細胞周囲の微小環境(ニッチ)との相互作用や隣接する幹細胞間での細胞競合を経て、あるいは様々な環境因子に起因するシグナルを経て幹細胞運命を制御する仕組みについて、ほ乳類の皮膚をモデルとして研究を進めています。その分子基盤の解明ならびに疾患発症や病態との関連の研究を通じて、幹細胞医学という新しい領域を創成し、創薬、先制医療、疾患治療へと応用することを目指しています。 |
| これまでの研究と現在進行中のプロジェクト | |
| 1) | 組織幹細胞の同定 |
| 2) | 老化形質の発現と癌発生のメカニズムの解明 |
| 3) | 毛包の老化と脱毛の仕組みの解明 |
| 4) | 表皮における幹細胞競合による皮膚の若さの維持と老化の仕組みの解明 |
| 1)組織幹細胞の同定 | |
| 皮膚は、体重の約16%を占める再生系臓器であり、外界から個体を隔て生命を護っている。表皮、真皮、皮下脂肪織から成り、毛包や汗腺などの付属器を持つ。表皮では、恒常的に角化細胞が新陳代謝を行なうのに対して,毛包は周期的に再生を行い、多くの細胞が毛周期ごとに新しく入れ替わる。皮膚は、その外観から変化が容易に検出できる上、アクセスが容易で幹細胞の運命追跡やin
vivo イメージングも可能であり多くの利点を持っている。これまでに哺乳類の毛包内の色素細胞系譜の幹細胞(色素幹細胞)(Nishimura EK.
et al., Nature, 2002)、加えて汗腺分泌部の色素幹細胞を発見しており(Okamoto N et al., PCMR, 2014)、メラノーマの起始細胞となっている可能性の検証、メラノーマの初期病変の病理診断への応用について検証をすすめている。表皮幹細胞は表皮基底層に存在することは知られていたが生体内における同定は困難であった。我々はCOL17A1を発現する表皮基底細胞を真の表皮幹細胞として同定することに成功した(Liu
N. et al., Nature, 2019)。 |
|
| 2)老化形質の発現と癌発生のメカニズムの解明 | |
| 白髪や脱毛は、哺乳類における最も典型的な老化形質の代表である.我々はこれまでに毛包幹細胞が色素幹細胞のニッチ細胞となることを示し(Nishimura EK et al., Cell Stem Cell, 2010)(Inomata K et al., Cell Stem Cell, 2011)加齢マウスの髭毛包内において、色素幹細胞がニッチ内において異所性に分化すること、これによって幹細胞が枯渇し色素細胞を供給できなくなるため、白髪が起こること,ゲノム毒性ストレスによってこれが促進すること,自己複製チェックポイントの関与を見い出した(Nishimrua EK et al., Science 2005)(Inomata K et al., Cell, 2009)(図1)。ヒトの加齢に伴う生理的な白髪においても、同様の細胞が加齢に伴いニッチに現れ、未分化な色素細胞が枯渇するため白毛化が起こる。さらに脱毛においても同様に毛包幹細胞が自己複製せずに表皮へと運命をかえて分化すると、これによって幹細胞プールが維持できなくなり毛包がミニチュア化して薄毛と脱毛が進行することを明らかにしている(Matsumura H et al., Science, 2016)(図2)。また、これらの幹細胞枯渇に基づく老化形質の発現と癌の発生と関連についても明らかにしている。 | |
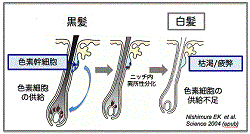 図1:加齢による色素幹細胞の枯渇/疲弊が色素細胞の不足による白髪を引き起こす |
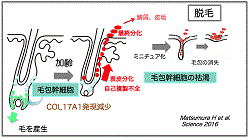 図2:加齢による毛包幹細胞の枯渇が毛包のミニチュア化と脱毛を引き起こす |
| 3)毛包の老化と脱毛の仕組みの解明 | |
我々の体を構築する組織や臓器の多くは、加齢に伴って器質的に変化すると同時にその機能レベルが低下する。我々は臓器老化モデルとして毛包の老化過程に着目し、毛の再生に重要な細胞を供給している毛包幹細胞の運命追跡を行なった。毛包幹細胞は加齢に遠なってDNA損傷応答が遷延するようになり、毛包幹細胞の維持において重要なXVII型コラーゲン(COL17A1/BP180)が失われると、表皮の角化細胞へと分化して皮膚表面から剥がれ落ちて失われていくこと、これによって毛包幹細胞とそのニッチが次第に縮小し、毛包自体が小型化(ミニチュア化)するため毛が細くなり失われていくことが明らかになった。さらに、マウスの毛包幹細胞においてCOL17A1の消失を抑えると、一連の加齢変化を抑制できた。以上のことから、組織に幹細胞を中心とした老化プログラムが存在すること(Matsumura H et al., Science, 2016)(図2)、さらに幹細胞分裂タイプが再生型から老化型へとスイッチし、これにより毛包の矮小化と脱毛を引き起こすことが明らかになった(Matsumura H et al., Nat Aging, 2021)(図3)。ヒトにおいてもその傍証を得たことから、その制御による脱毛症の予防や治療への応用に向けた応用研究を進めている。 |
|
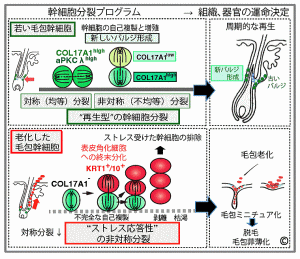 図3: 毛包の幹細胞分裂タイプの違いが器官の再生・老化を決定づける (Matsumura H et al. Nat Aging, 2021) |
|
| 4)表皮における幹細胞競合による皮膚の若さの維持と老化の仕組みの解明 | |
| 表皮などの重層扁平上皮においては生涯にわたって個体を外界から隔てて生命を維持し続けており、毛包よりも遥かに長期に渡って機能し続ける。その仕組みを明らかにするために表皮幹細胞のクローン解析を行った。その結果、表皮幹細胞が隣接する幹細胞との間でCOL17A1の発現差に基づく細胞競合を行なっており、これによって表皮角化細胞の若さ(質)を保ち老化をを抑制していることが明らかになった(図4)。しかし加齢に伴い幹細胞競合がおこらなくなり、色素細胞や線維芽細胞なども失われ皮膚が老化することが明らかになった。さらに加齢に伴うCOL17A1を制御するシグナルの変化により幹細胞の分裂様式や運動性が変化し創傷治癒能力が落ちることを明らかしている。今後、他の上皮系臓器でも同じように幹細胞競合や分裂様式の変化、運動性が臓器の若さ(品質)や機能維持や再生において共通原理としてはたらく可能性について検証し、加齢関連疾患との関連、予防や治療の戦略についても探る予定である。 |
|
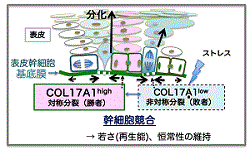 図3:表皮幹細胞はCOL17A1を介した細胞競合 を行い、皮膚の向上性を維持している。 (Liu N et al. Nature 2019) |
|
| -主な発表論文- | ||
| 1) | Matsumura H, Liu N, Nanba D, Ichinose S, Takada A, Kurata S, Morinaga H,
Mohri Y, De Arcangelis A, Ohno S, Nishimura EK Distinct types of stem cell divisions determine organ regeneration and aging in hair follicles. Nature Aging, 1:190-204, 2021 |
|
| 2) | Liu N, Matsumura H, Kato T, Ichinose S, Takada A, Namiki T, Asakawa K,
Morinaga H, Mohri Y, De Arcangelis, Geroges-Labouesse E, Nanba D, Nishimura
EK Stem cell competition orchestrates skin homeostasis and ageing. Nature, 568(7752):344-350, 2019 |
|
| 3) | Matsumura H, Mohri Y, Binh NT, Morinaga H, Fukuda M, Ito M, Kurata S, Hoeijmakers
J, Nishimura EK. Hair follicle aging is driven by transepidermal elimination of stem cells via COL17A1 proteolysis. Science, 351(6273):575-589, 2016 |
|
| 4) | Okamoto N, Aoto T, Uhara H, Yamazaki S, Akutsu H, Umezawa A, Nakauchi H,
Miyachi Y, Saida T, Nishimura EK. A melanocyte-melanoma precursor niche in sweat glands of volar skin. Pigment Cell & Melanoma research, 27(6):1039-1050, 2014 |
|
| 5) | Tanimura S, Tadokoro Y, Inomata K, Nishie W, Yamazaki S, Nakauchi H, Tanaka
Y, Mcmillan JR, Sawamura D, Yancey K, Shimizu H, Nishimura EK. Hair follicle stem cells provide a functional niche for melanocyte stem cells. Cell Stem Cell, 8(2):177-187, 2011 |
|
| 6) | Nishimura EK, Suzuki M, Igras V, Du J, Lonning S, Miyachi Y, Roes J, Beermann
F, Fisher DE. Key roles for transforming growth factor β in melanocyte stem cell maintenance. Cell Stem Cell, 6(2):130-40, 2010 |
|
| 7) | Inomata K, Aoto T, Binh NT, Okamoto N, Tanimura S, Wakayama T, Iseki S,
Hara E, Masunaga T, Shimizu H, Nishimura EK. Genotoxic stress abrogates renewal of melanocyte stem cells by triggering their differentiation. Cell, 137(6):1088-99, 2009 |
|
| 8) | Nishimura EK., Granter SR, Fisher DE. Mechanisms of hair graying:incomplete melanocyte stem cell maintenance in the niche. Science, 307(5710):720-724, 2005 |
|
| 9) | Nishimura EK, Jordan SA, Oshima H, Yoshida H, Osawa M, Moriyama M, Jackson
IJ, Barrandon Y, Miyachi Y, Nishikawa S. Dominant role of the niche in melanocyte stem cell fate determination. Nature, 416(6883):854-60, 2002 |
|