 B.骨軟骨分化に関与する新規遺伝子の単離とその発現、機能解析 (辻 邦和、野田政樹)
B.骨軟骨分化に関与する新規遺伝子の単離とその発現、機能解析 (辻 邦和、野田政樹)
A.骨格形成の分子機構に関する研究(二藤 彰、野田政樹)
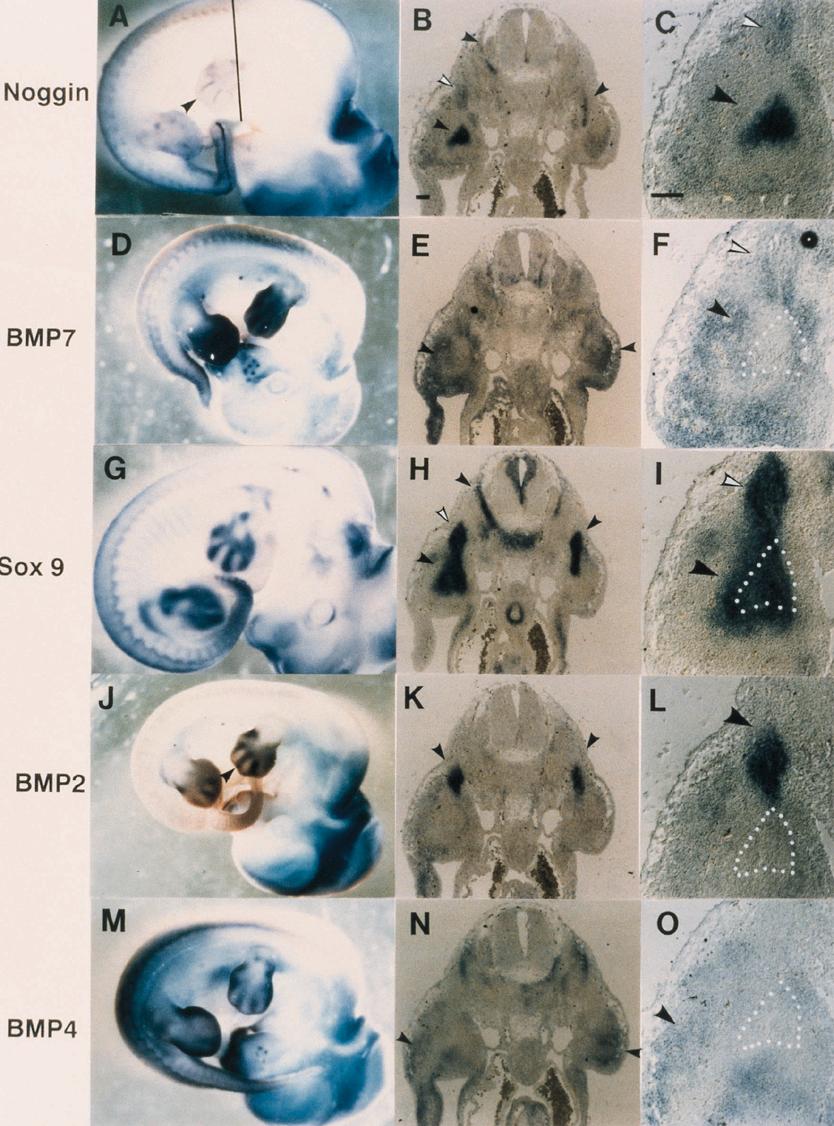
骨格前駆細胞から軟骨をへて骨組織形成に至る過程は、胎児期のみならず成体での骨組織の再生過程でも再現されると考えられており、その分子機構を明らかにすることは、骨格形成過程の理解にとどまらず、臨床的にも治療および病態の理解に寄与する面が大きい。我々は骨格形成過程において働く分子の同定と、それら分子間の相互作用を明らかにすることで、骨格形成の分子機構を理解したいと考えている。BMPは骨格形成過程の重要な制御因子であるが、これまでBMP阻害分子のひとつnogginがBMPシグナルのターゲットであること、骨格形成過程でBMPとnogginの発現部位が近接していること、noggin 自身が骨格原基で特異的に発現することを明らかにしてきた。本年度はBMPとnoggin の相互作用をより詳細に検討するために、nogginを発現するアデノウイルスベクター(Ad/noggin)を構築し、細胞培養並びに器官培養における強制発現を試みた。Ad/nogginは外来性のBMPにたいし、効果的な阻害を示すことが確認された。内軟骨性骨化が始まった時期の胎児の長管骨にBMPを作用させると長軸方向の伸長が認められ、Ad/nogginによっては逆に伸長が抑えられた。特に軟骨に対して著しい抑制効果が認められたが骨組織成長への抑制効果は認められなかったので、細胞培養における分化モデルC1を用いて作用をより詳細に検討した。C1細胞にAd/nogginを感染させても増殖には影響を及ぼさないが、感染後に軟骨に分化させたところ、その分化形質の発現はすべて抑制された。一方同じC1細胞を感染後、骨芽細胞に分化させてもその分化形質には影響を及ぼさなかった。以上の結果より、BMPによる正の制御と nogginによる負の制御は主として軟骨分化において行われる可能性が示唆された。
 B.骨軟骨分化に関与する新規遺伝子の単離とその発現、機能解析 (辻 邦和、野田政樹)
B.骨軟骨分化に関与する新規遺伝子の単離とその発現、機能解析 (辻 邦和、野田政樹)
本研究では、骨、軟骨細胞において発現し、その分化形質の発現に関与する新規遺伝子の検索を通して、細胞分化の分子機構の解明を目指している。 Runx2は、Drosophilaの体節決定に必要であるpair-rule遺伝子の一つ、runtに相同な配列(runt domain)を持つ遺伝子で、ノックアウトマウスの実験から、この転写因子が骨芽細胞、軟骨細胞の分化に必須であることが示されている。骨分化マーカー遺伝子であるオステオカルシン、オステオポンチン、I型コラーゲンのプロモータ領域においてもRunxの結合配列が存在していることから、骨芽細胞の終末分化において中心的に機能しているのは、Runx2であると考えられている。Runx2のノックアウトマウスでは、興味深いことに、骨のパターニングに異常が見られないことから、Runx2は骨形成において、パターンが決定された後、骨芽細胞へのコミットメントの段階に機能していると考えられる。このことから、骨においてRunx2の発現制御に関わる遺伝子は、骨細胞分化において重要な意味を持つと考える。Runx2のプロモータ領域の配列情報の解析は既に行われており、転写開始点の上流及び下流に合計6箇所のRunt結合配列が存在していることが明らかとなっている。このことはRunx2 の発現が、Runx2または他のRunxファミリーによって制御されていることを強く示唆している。Runx2はマウス胎生11日目付近で、将来の骨予定領域において強い発現が見られるが、この時期に発現し、Runx2の発現を誘導するRunxファミリーを同定するために、マウス11日胚のcDNAライブラリーを用いて、runt domainを持つ遺伝子のスクリーニングを行った。その結果、AML1b(human Runx1)とexon6まで同一の構造をもち、exon7から異なるコーディングシークエンスを持つ新規Runx1アイソフォーム(#521-41)を単離した。#521-41の発現解析を行ったところ、この遺伝子はマウス胎生6日胚において既に強い発現が見られ、発生とともに発現量は減少した。成体においては、脳、心臓、腎臓、脾臓、卵巣、骨格筋に広く発現していたが、特に骨(腰椎)において強い発現が見られた。骨芽細胞様細胞株、MC3T3E1においても恒常的な発現が観察された。
C. B/BのMitf遺伝子の変異が大理石骨病を起こすメカニズムについての検討(川口奈奈子、野田政樹)
Mitf遺伝子はbHLH―ZIP構造をもつ転写因子であり、basicのArgが欠損する変異を有するmi/miマウスにおいては、小眼、色素細胞分化の異常。マスト細胞の減少、大理石骨病が観察される。この遺伝子のbasicの領域で、HisがArgに替わる変異と、ZIPに続く部分からのC端側の欠損の変異を有するシルバーウズラのホモ(B/B)において、大理石骨病が観察される。mi/miのMitfは、核移行が阻害されるので、野生型あるいはB/B のMitf遺伝子をNIH3T3細胞に強制発現させてその細胞内局在を検討したところ、野生型と同様に B/BのMitfも核内に存在することが明らかとなった。したがって、 B/Bウズラは、mi/miマウスとはこの点において異なるメカニズムが考えられる。また、 B/Bウズラは、月齢とともに、大理石骨病が治癒されることは見られなかったので、ageとともに大理石骨病が治癒するmib/mibラットととも異なるメカニズムと考えられる。Mior/Miorマウスと同様に、核移行は可能であるが、標的遺伝子に結合できないことによって大理石骨病が起こる可能性について現在検討している。
D. Klotho 遺伝子変異マウスの成長板軟骨における形態学的異常 (麻生義則、山下照仁、野田政樹)
早期老化に似た表現形を呈するklotho遺伝子変異マウス(kl/klマウス)の成長板軟骨における形態学的異常の有無を検索する目的にて野生型、kl/klマウスの大腿骨、脛骨の成長板軟骨を組織学的、免疫組織学的に観察した。成長板軟骨の静止層から増殖層、および前肥大細胞層から肥大細胞層の厚さを比較すると、成長板軟骨全層の厚さに差はなかったが、静止層から増殖層の厚さはkl/klマウスにおいて有意に減少していた。またkl/klマウスにおいては軟骨細胞の配列に乱れを生じており、軟骨の柱状構造の数は減少していた。細胞個々においては肥大軟骨細胞のlacunaeの大きさが、kl/klマウスにおいて有意に縮小していた。肥大細胞層から一次骨梁の移行部についての観察では、kl/klマウスにおいて一次骨梁の幅が大きく、その形態も不整であった。この成長板軟骨の形態異常発生のメカニズムを探索する為に生後4週の脛骨切片にてTUNEL染色を施行すると、静止細胞層にてkl/klマウスにおいてはTUNEL陽性細胞数が増加していた。以上よりkl/klマウスにおいては成長板軟骨の形態に異常が認められ、軟骨細胞のapoptosis亢進がその要因となっている可能性が示唆された。
E. オステオポンチンは破骨細胞の接着、血管形成を介して異所性骨の吸収を促進する。 (麻生義則、辻邦和、二藤彰、野田政樹)
異所性に移植された骨の吸収過程におけるオステオポンチン(OPN)のin vivoにおける機能を解析するために、野生型(WT)、及び OPN-KO マウスの頭頂骨より作成した頭頂骨円板を、被移植動物となる野生型、及び OPN-KO マウスに異所性に移植し、破骨細胞の誘導、骨吸収能、および血管形成への関与についてOPNの役割を検討した。WT、及び OPN-KOマウスの頭頂骨より頭頂骨円板を作成し、これらを被移植動物となる野生型、OPN-KOマウスの皮下、あるいは傍脊柱筋の筋内に移植した。筋内移植後4週にて円板を抜去し、その骨吸収領域を定量した結果、骨吸収領域は頭頂骨円板、被移植動物共にWTの群において最も大きく、これらが共にOPN-KOの群において最も小さかった。被移植動物、円板いずれかがOPN-KOの場合はこれら2群の中間の骨吸収領域を示した。すなわち骨吸収の過程では骨基質側ならびに破骨細胞側(被移植動物側)の両者からのOPNが機能することが示唆された。これらの骨円板を免疫組織学的に観察すると、円板表面に接着する破骨細胞数、および誘導された血管数は被移植動物、円板いずれもWTの群に対していずれもOPN-KOの群において減少していた。皮下に移植された頭頂骨円板においても同様の結果が得られ、OPNが破骨細胞のリクルートメントや血管新生に必要であることが示唆された。
F. オステオポンチンノックアウトマウスを用いた腫瘍転移の抑制に関する研究 (根本啓行,儀武啓幸,古屋高一,辻 邦和,二藤 彰,野田政樹)
腫瘍の転移は一連の複数の段階、すなわち原発巣からの細胞の離脱、血管・リンパ管内への細胞の浸潤、血管内皮への接着、血行性あるいはリンパ行性の移動、転移部位への侵入、そこでの増殖、血管新生の誘導などからなる。高転移能の腫瘍ではこれらのひとつあるいはそれ以上の段階が増強されていることが知られている。オステオポンチンはその高レベルの発現が高転移能を持つ腫瘍と相関があることが報告されており、一般には分泌型骨器質タンパクかつサイトカインとして、骨および腎臓、肺、神経組織などの骨以外の軟組織に存在すると知られている。オステオポンチンはその発現を人為的に抑制された腫瘍細胞で転移活性が抑制されることが知られている。他方でオステオポンチンの増加は腫瘍の悪性化と相関があるということ、これらの細胞でPKCにより誘導されたαvβ3インテグリンの活性が転移活性を上昇させることも報告されている。そこで、宿主のオステオポンチンの発現が腫瘍の転移にどのように寄与するかを検討するために、その欠損による実験的腫瘍転移の多寡を調べた。悪性黒色種は最も転移能の高い腫瘍の一つであり高頻度に骨に転移することが知られている。B16マウス悪性黒色種細胞株もまた自らはオステオポンチンをほとんど発現しないにも関わらず多くの臓器に移転することが知られている。また左心室に注入されると骨に、静脈に注入されると肺に高率に転移する。そこで我々はB16細胞をオステオポンチンノックアウトマウスおよび野生型マウスのそれぞれの経路に注入する動物モデルを作製し転移効率を検討した。 その結果、以前の報告通り動脈内注入においては骨で、静脈内注入では肺で高頻度の転移が観察されたが,オステオポンチンノックアウトマウスを用いた系ではそのいずれも有意に転移効率が低下した。またin vitro の系では、オステオポンチンは細胞接着にのみ影響を与え、この系においては宿主側のオステオポンチン依存性に細胞接着機能が亢進することも同時に示された。
G. オステオポンチンの非荷重による骨量減少における機能(石島旨章、山下照仁、辻 邦和、二藤 彰、野田政樹)
骨への力学的負荷亢進は骨量を増加させ、その軽減は骨量の低下を招く。現在臨床的に特に問題となるのは、骨折後の免荷や長期臥床などの負荷軽減による骨量減少であり、宇宙飛行に伴う骨量減少も解決されるべき課題である。その機序の解明と予防のために、代表的な負荷軽減モデルである尾部懸垂モデルを用いた動物実験が数多く行われてきた。このモデルでは尾部懸垂に伴う骨吸収亢進と骨形成低下により後肢の骨量は減少する。骨吸収阻害剤や破骨細胞分化抑制因子の投与による予防の試みでは、骨吸収亢進は阻害されるものの骨形成低下を抑制する事はできず、負荷軽減に伴う骨形成低下の機序は依然不明であった。今回、骨基質リン酸蛋白で破骨細胞や骨芽細胞の機能を制御すると考えられているオステオポンチンに着目した。オステオポンチンは骨吸収機能に重要な役割を担うことが知られ、さらに、作用機序は不明なものの力学的負荷の変化に伴う骨形成あるいは骨吸収にも関与するとの報告がある。そこでオステオポンチンノックアウトマウスにこの尾部懸垂モデルを行い、負荷軽減による骨量減少における役割を探った。するとオステオポンチンノックアウトマウスでは、野生型マウスでみられた骨量減少が抑制され、それは骨吸収亢進の抑制だけでなく骨形成低下も抑制されていた。このことはオステオポンチンが力学的負荷軽減による骨量減少に対して、従来知られていた骨吸収機能への作用だけでなく、骨形成系のシグナルにも関与する可能性を示唆している。今回の結果は、従来不可能であった力学的負荷軽減による骨形成低下を抑制した初めてのものであり、今後この負荷軽減による骨形成系の制御を考える上で重要な知見が得られたものと考えている。
H. Tobノックアウトマウスにおける骨形成亢進の分子生物学的研究 (臼井道彦、山下照仁、野田政樹)
BMPのシグナリングは様々なアンタゴニストによって制御されている。細胞外ではNogginをはじめとするアンタゴニストにより受容体への結合を阻害され、細胞内においてはSmad6,7並びに、Smurfによるユビキチン化によってシグナリングが抑制されていることが知られている。 Tob(transducer of ErbB2)は癌遺伝子であるErbB2をプローブとして用いて、クローニングされた転写因子である。この蛋白はNIH3T3細胞において過剰発現させた場合、その細胞増殖が抑制されることが知られていた。しかし、その生物学的意義をわかっておらず、これを明らかにするために東京大学医科学研究所の吉田等はTobノックアウトマウスを作製した。Tobノックアウトマウスは正常に生まれ、成長し、生殖機能も有していたが、生後2ヶ月過ぎになると野生型に比べ骨量の増加が認められた。骨吸収のパラメーターが正常であったことから、骨形成において異常があることが示唆された。そこで、我々は骨形成因子の一つであるBMPによる骨形成におけるTobの欠損の影響を明らかにすることを目的として、Tobノックアウトマウスの頭蓋骨へのBMP投与後の骨形成、及び、大腿骨骨髄除去後の骨形成について解析を行なった。10日間BMPを投与後、頭蓋骨にできた新生骨を定量した結果、Tobノックアウトマウスでは野生型に比べ、骨量が有意に増加していた。それに対して、外因性のBMPによらない骨形成モデルである骨髄除去モデルでは、骨髄除去10日後の新生骨において、Tobノックアウトマウスと野生型の間でその骨量に有意な差は見られなかった。これらのことより、骨形成におけるTobの効果はBMPに誘導される骨形成特異的であることが示唆され、さらに、Tobが骨代謝においてBMPに対する新しいタイプのアンタゴニストとして働いていることが示唆された。
I. Klotho遺伝子変異マウスにおける骨吸収異常の研究 (鹿島田健一、山下照仁、野田政樹)
Klotho遺伝子変異マウスは成長障害、寿命の短縮など老化に類似した表現型がみられるが、骨においても骨幹端部における著名な海綿骨の増加、および骨幹中央部における皮質骨の減少といった変化がみられる。先にわれわれのグループではklotho変異マウスの骨形成と骨吸収を検討するために骨髄除去モデルを作成し、klotho変異マウスにおいては破骨細胞分化抑制因子(Osteoprotegerin/OCIF)の発現の上昇とそれに伴う新生骨吸収の低下が認められることを報告した。Klotho変異マウスにおける骨吸収の機構をさらに調べるために、骨形成低下に対する骨吸収を一側の坐骨神経離断による廃用性骨萎縮モデルを作成し検討した。4週齢の野生型およびklotho遺伝子変異マウスのそれぞれ一側の坐骨神経離断術を行い、術後13日および30日後の大腿骨を採取、μCTを用いて海綿骨、皮質骨量の比較を行った。その結果、大腿骨骨幹端部における海綿骨量は野生型マウスでは術後13日よりすでに術側の減少傾向が認められ、術後30日では対側に比して約30%の優位な減少を認めた。一方klotho変異マウスにおいては術後13日において野生型と同様の骨量減少傾向を認めたものの、術後30日においては海綿骨量の減少は10%にとどまった。同様に骨幹中央部における皮質骨面積を比較したところ術後30日において野生型では神経離断側が対側に比して20%の減少を認めたのに対して、klotho変異マウスでは差を認めなかった。以上よりklotho変異マウスにおいては、力学的負荷の軽減による骨量減少の過程においてなんらかの異常がみられることが示唆された。ラットの尾部懸垂による骨廃用性萎縮モデルにおける骨量減少がOPGの投与によって抑制されることがすでに報告されており、これらからklotho変異マウスにおいては発現が亢進しているOPGが、力学的負荷の軽減による骨吸収の亢進を抑制している可能性が考えられた。