研究の概要
 ポリシー
ポリシー
1 新しいパラダイムを求める
生命現象の基本的な理解を変えていくような研究を行うことをめざしています。実際に、これまで基本的
な問題にとりくみ、抗原と反応したB細胞が免疫応答をおこすのか、不応答になるのかのスイッチ機構の
解明を行ってきました。この機構は、抗体応答が正常な個体では病原微生物に対してはおこり、自己
抗体や花粉、食物などの環境抗原にはおこらないという、免疫応答の基本的な仕組みに関与すると
考えられます。 これまでにタンパク抗原への応答・不応答決定の仕組みはほぼ明らかになってきたので、
現在は糖鎖や核酸などの非タンパク抗原への応答・不応答の決定機構の解明を行なっています。 また、
ワクチンの効果に関わる基本的な免疫の仕組みの解明や、B細胞活性化における細胞ストレスの役割の
解明を行なっています。
2 新領域の開拓をめざす
これまでの学問領域の枠を越えた新領域の開拓をめざしています。液性免疫応答における糖鎖シグナ
ルの研究を推進し、糖鎖免疫学の開拓を行っています。さらに、本学におけるケミカルバイオロジーの研
究基盤整備にあわせ、化合物を駆使した免疫学研究の展開を図ります。
3 免疫疾患の新たな治療法や新たなコンセプトのワクチンの開発をめざす
現在、記憶Bリンパ球の知見をもとに、新たなコンセプトに基づく感染防御法の開発を行なっています。
 研究テーマ
研究テーマ
1.糖鎖や核酸抗原に対する免疫応答の制御機構--糖鎖免疫学の展開
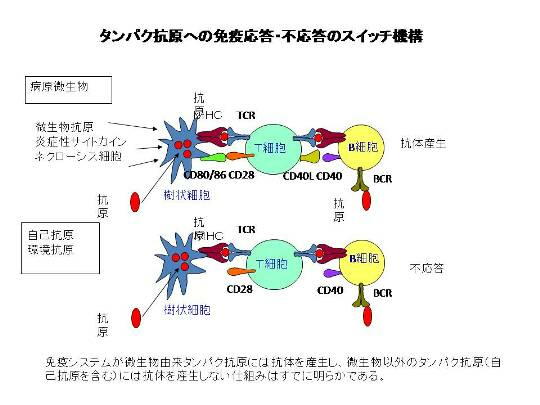
タンパク抗原への免疫応答・不応答の決定機構は明らかになっている。
抗体は免疫応答におけるもっとも重要なエフェクター分子の1つであり、感染防御や自己免疫疾患、アレ
ルギーで重要な役割を果たす。正常個体では、抗体は感染微生物に対して産生されるが、自己抗原や
アレルゲンに対しては産生されない。このような抗原の種類によって抗体産生がおこるかおこらないかの
決定機構は、タンパク抗原の場合にはほぼ理解されていると言ってよい。
微生物の侵入の際に、微生物抗原そのもの(PAMPs: pathogen-associated molecular pattern)や炎
症性サイトカインが危険シグナルとして樹状細胞を成熟させ、成熟樹状細胞がTリンパ球を活性化し、
活性化したTリンパ球がBリンパ球をヘルプすることにより抗体産生がおこる。自己抗原や微生物以外
の異物は、危険シグナルを生成しないために、樹状細胞を成熟させない。このため、Tリンパ球やBリン
パ球の活性化がおこらず抗体産生もおこらない。
Tリンパ球によるBリンパ球のヘルプでもっとも重要なシグナルは、Bリンパ球上のCD40分子を介するシ
グナルで、Bリンパ球表面のCD40分子が活性化Tリンパ球の発現するCD40Lに反応して誘導される。
CD40を介するシグナルは抗原と反応したBリンパ球のアポトーシスを阻害し、活性化を誘導する。この
ようなCD40シグナルの役割については、我々のグループが世界に先駆けて明らかにしたものである
(Tsubata et al. Nature 1993, Hokazono et al. J. Immunol. 2004)。
非タンパク抗原への応答・不応答の決定機構は感染防御や自己免疫の防止
で重要であるが、その仕組みは未解明である
抗体はタンパク抗原ばかりでなく、糖鎖や核酸に対しても産生される。糖鎖に対する抗体産生は細菌感
染防御で重要である。また、糖鎖や核酸に対する自己抗体産生は自己免疫疾患の発症で重要な役割
を果たす。このことは、タンパク抗原だけでなく、糖鎖や核酸に対しても、微生物由来抗原には反応し、
自己や環境抗原については反応しない仕組みがあり、この仕組みが感染防御や免疫疾患の防止で重
要であることを示している。
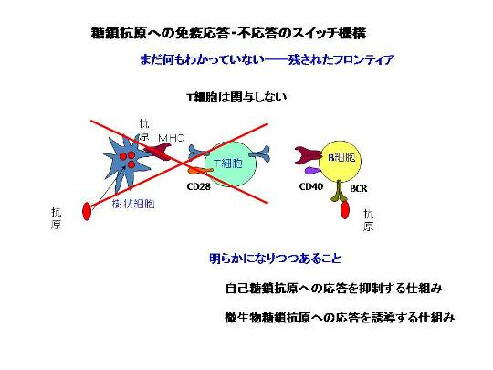
Tリンパ球は糖鎖や核酸を認識しないので、糖鎖や核酸抗原に対する応答・不応答にTリンパ球ヘルプ
は関与しない。これまで、どのような機構で自己の糖鎖等には免疫応答がおこらず、病原微生物由来の
糖鎖抗原には免疫応答がおこるのかは不明あった。我々は、自己の糖鎖抗原を認識してBリンパ球の活
性化を阻害して自己の糖鎖抗原への抗体産生を抑制する仕組みと、微生物由来の糖鎖抗原を識別して
Bリンパ球を活性化し、微生物糖鎖への抗体を産生する仕組みの2つが存在することを明らかにしている
(未発表)。現在、これらの仕組みの詳細についての解明を行なっている。
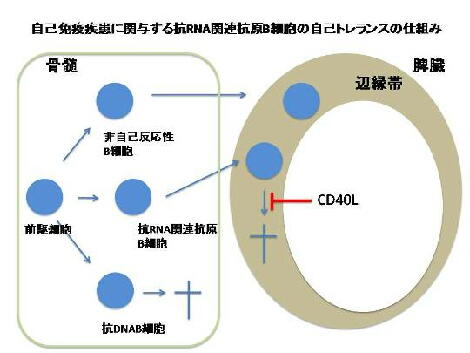
SLE発症に関わる核酸関連自己抗原への自己抗体産生Bリンパ球の抑止機構とその破綻
核酸関連自己抗原への抗体産生は、代表的な自己免疫疾患の1つである全身性エリテマトーデス
(SLE)の発症で重要な役割を果たす。自己抗原への抗体産生には、前述のような応答・不応答のス
イッチ以外に、自己反応性Bリンパ球への種々の抑制機構(トレランス機構)が働くことにより、自己
抗体の産生が厳密に抑止されている。近年、SLE発症においてSm抗原などのRNA関連抗原への自
己抗体産生が重要な役割を果たすことが明らかとなっている。
SLEではBリンパ球の応答・不応答のスイッチであるCD40Lの過剰産生がおこり、さらに、抗CD40L抗
体によりCD40Lの機能を阻害すると症状が顕著に改善することが知られている。このことは、CD40L
過剰産生sがSLEの発症で何らかの役割を果たしていることを示している。我々は、CD40Lを過剰発現
するマウスでSLE様の自己免疫疾患を発症することを明らかにした(Higuchi et al. J. Immunol. 2002)
が、最近、CD40Lが脾臓辺縁帯においてRNA関連抗原に反応する自己反応性Bリンパ球のアポトーシ
スを阻害することにより、疾患関連自己抗体の産生をおこすことを明らかにした(Kishi et al. PNAS
2012)。この知見は、RNA関連抗原へのBリンパ球の自己トレランスが他の自己反応性Bリンパ球のト
レランスとは異なる特異的なものであることを示している。さらに、RNA関連抗原へのBリンパ球自己ト
レランス破綻の解明を行い、SLE発症のメカニズムに迫ろうとしている。
2.免疫記憶による感染防御の仕組みの解明と、新たなコンセプトに基づく
感染防御法の開発
ワクチンの効果とは?
病原微生物の感染や、ワクチン接種により感染防御が成立する。これは、その病原微生物に反応する
記憶リンパ球が産生され、体内で長く生存するためである。始めて微生物に感染すると、約1週間後に
初期型のIgM抗体が産生され、2週目に大量のIgG抗体の産生がおこる、IgG抗体は微生物を効率良く
排除する。一方、記憶Bリンパ球は感染後速やかに抗体産生をおこし、症状がおこる前に微生物を排
除する。このため、ワクチンにより微生物から守られることになる。
記憶Bリンパ球が速やかに大量の抗体を産生する仕組みの解明
ナイーブBリンパ球はIgMおよびIgDを抗原受容体として細胞表面に発現するが、記憶Bリンパ球はもっ
ぱらIgGを抗原受容体として発現する。我々の成果(Wakabayashi et al. Science 2002, Man et al.
PLoS ONE 2010)などにより、IgG抗原受容体を介するシグナル伝達が、IgG抗原受容体を介するシグ
ナル伝達がIgMやIgDを介するシグナル伝達に比べて増強しており、Bリンパ球の迅速な活性化をおこ
すことが明らかとなってきた。したがって、記憶応答の際の迅速な抗体産生には、IgG抗原受容体によ
る増強したシグナル伝達が重要な役割を果たす。現在、我々の研究室では、IgG抗原受容体によるB
リンパ球の活性化増強の分子メカニズムの解明を行なっている。
新しいコンセプトによる画期的な感染防御法の開発
IgM抗原受容体の機能を制御することによりIgG抗原受容体と同様にシグナル伝達を増強することが
できれば、ワクチン等で記憶Bリンパ球を生成しなくても微生物に対する抗体を迅速に産生し、ワクチ
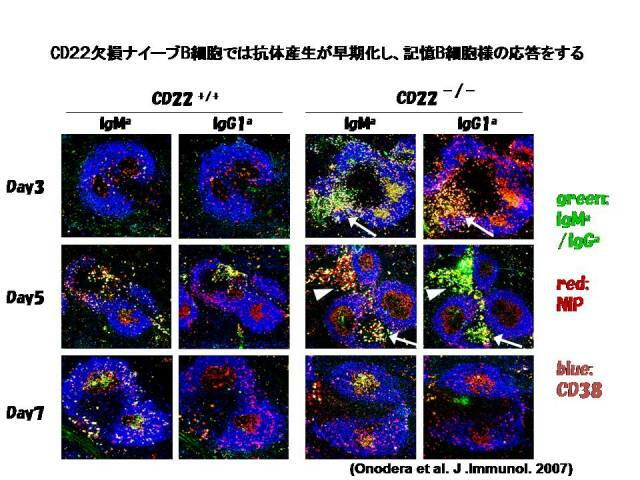
ンと同様の感染防御ができるはずである。Bリンパ球が発現する抑制性受容体CD22/Siglec2が抗
原受容体シグナル伝達を負に制御することが知られていたが、我々は、CD22欠損ナイーブBリンパ
球が免疫応答の際に記憶Bリンパ球と同様に迅速に活性化して抗体産生をおこすことを明らかにし
た(Onodera et al. J. Immunol. 2008)。したがって、CD22の阻害剤を開発することができれば、ワク
チンを使用しなくてもワクチンと同様に感染を防御する画期的な感染防御法の開発が可能になる。
CD22のリガンドはシアル酸であるが、現在、我が国のシアル酸合成の第一人者である岐阜大学の
木曽教授、石田教授と共同で、CD22阻害剤の開発を行なっている(Abdu-Allah et al. J. Med. Chem.
2008, Tetrahedron Lett. 2009, Bioorg. Med. Chem. Lett. 2009, Bioorg. Med. Chem. 2011)
3.Bリンパ球シグナル伝達の細胞生物学的研究
Bリンパ球抗原受容体架橋により、エンドサイトーシス、オートファジー、アポトーシスなどの種々の細胞
生物学的な変化がおこるとともに、酸化ストレスや小胞体ストレスなどがおこる。これらの細胞生物学的
な現象はシグナル伝達とも密接に関与することが明らかになりつつある。我々は、上記の研究とも密接
に関連付けながら、これら細胞生物学的な変化がシグナル伝達をどのように制御するのかという視点で
研究を進めている(Hirai et al. Cell Death Differ. 2004, Yan et al. BBRC 2008, Watanabe et al. BBRC
2008, Watanabe et al. Autophagy 2009)。
|
