研究紹介
生活習慣病(肥満・糖尿病)やサルコペニアなど、加齢関連疾患の病因と病態の解明を目指しています。
動脈硬化を原因とする心筋梗塞や脳梗塞、糖尿病・糖尿病や慢性腎臓病などの生活習慣病は世界的に増加しています。一方、加齢に伴う筋量の低下をサルコペニアと呼び、高齢者が生活の質(QOL)の低下を招く重要な要因として注目されています。私たちはこのような身近な病態の解明と、有効な新規治療・予防法の開発を目指して研究を行っています。
動脈硬化を原因とする心筋梗塞や脳梗塞、糖尿病・糖尿病や慢性腎臓病などの生活習慣病は世界的に増加しています。一方、加齢に伴う筋量の低下をサルコペニアと呼び、高齢者が生活の質(QOL)の低下を招く重要な要因として注目されています。私たちはこのような身近な病態の解明と、有効な新規治療・予防法の開発を目指して研究を行っています。
①炎症慢性化のメカニズム解明
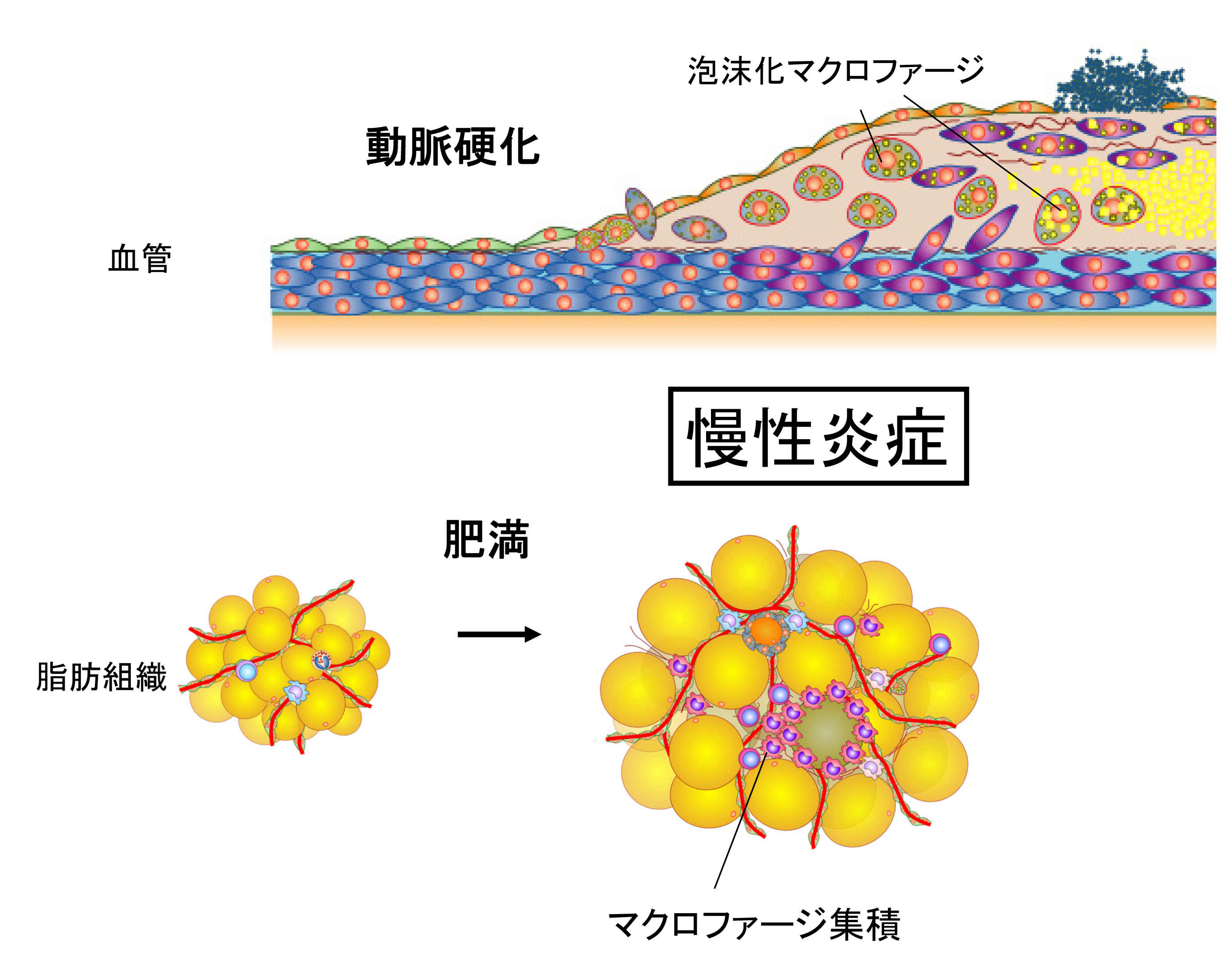
肥満や生活習慣病、がんに共通した病態として、慢性炎症が注目されています。慢性炎症は、種々のストレスに対する応答としてはじまった炎症が、適切に収束せずに遷延した病態と考えることができます。ところが、なぜ炎症が慢性化するのか、そのメカニズムは明確ではありません。
そこで私たちは、慢性炎症の病態形成に重要なマクロファージに着目し、炎症の慢性化を引き起こすメカニズムを、分子生物学的手法と、最新のトランスクリプトーム・エピゲノム解析とを組み合わせて解明しています。特に、マクロファージの細胞機能としての免疫応答と細胞代謝が密接に連携していることに注目し、マクロファージの細胞代謝を標的とした慢性炎症に対する治療・予防法の開発を目指しています。
最近では、生活習慣病のみならず、不妊の原因となる慢性子宮内膜炎や強大音暴露による難聴の病態、創傷治癒過程における肥厚性瘢痕(ケロイド)にも慢性炎症の機序が関与していると想定され、各臨床科の先生方とともにこれらの病態の解明と新規治療法の開発にも取り組んでいます。
そこで私たちは、慢性炎症の病態形成に重要なマクロファージに着目し、炎症の慢性化を引き起こすメカニズムを、分子生物学的手法と、最新のトランスクリプトーム・エピゲノム解析とを組み合わせて解明しています。特に、マクロファージの細胞機能としての免疫応答と細胞代謝が密接に連携していることに注目し、マクロファージの細胞代謝を標的とした慢性炎症に対する治療・予防法の開発を目指しています。
最近では、生活習慣病のみならず、不妊の原因となる慢性子宮内膜炎や強大音暴露による難聴の病態、創傷治癒過程における肥厚性瘢痕(ケロイド)にも慢性炎症の機序が関与していると想定され、各臨床科の先生方とともにこれらの病態の解明と新規治療法の開発にも取り組んでいます。
②加齢に伴う筋再生不全の分子機序の解明とサルコペニア治療・予防法の開発
骨格筋は運動や姿勢の保持のみならず、身体で最大の糖代謝臓器として、エネルギー代謝においても重要な役割を果たしています。運動不足や、長期の寝たきり、または加齢によって筋肉が萎縮すると、運動機能の低下を引き起こすのみならず、生活習慣病リスクが増加し、その後の生活の質に多大な影響を及ぼします。加齢に伴う筋量・筋力の低下はサルコペニアと呼ばれ、高齢化を迎えた我が国において近年、罹患者の増加が大きな問題となっています。
一方、骨格筋は再生能が高い臓器です。筋損傷後の再生において、骨格筋特異的幹細胞である“筋衛星細胞“が重要な役割を担います。筋衛星細胞は、通常は休止期にありますが、筋損傷が起こると活性化し、増殖・分化し、やがて新しい筋線維を作ります。また、筋衛星細胞は自分自身を複製し、常に一定数を維持することによって次の損傷に備え、生体の恒常性の維持に寄与しています。一方、損傷後の筋組織には炎症が生じ、免疫細胞も多数集結します。マクロファージを除去してしまうと筋再生が著しく遅延することから、筋損傷後の再生の過程では、マクロファージが特に重要な役割を担うことが知られています。
そこで私たちは、マクロファージをはじめとした免疫細胞と筋衛生細胞との相互作用に着目し、筋損傷後の再生と炎症とが協調して制御されるメカニズムを、シングルセル解析をはじめとした最新の手法を用いて明らかにし、サルコペニアの予防・新規治療法の開発に向けた知識基盤を作りたいと考えています。
一方、骨格筋は再生能が高い臓器です。筋損傷後の再生において、骨格筋特異的幹細胞である“筋衛星細胞“が重要な役割を担います。筋衛星細胞は、通常は休止期にありますが、筋損傷が起こると活性化し、増殖・分化し、やがて新しい筋線維を作ります。また、筋衛星細胞は自分自身を複製し、常に一定数を維持することによって次の損傷に備え、生体の恒常性の維持に寄与しています。一方、損傷後の筋組織には炎症が生じ、免疫細胞も多数集結します。マクロファージを除去してしまうと筋再生が著しく遅延することから、筋損傷後の再生の過程では、マクロファージが特に重要な役割を担うことが知られています。
そこで私たちは、マクロファージをはじめとした免疫細胞と筋衛生細胞との相互作用に着目し、筋損傷後の再生と炎症とが協調して制御されるメカニズムを、シングルセル解析をはじめとした最新の手法を用いて明らかにし、サルコペニアの予防・新規治療法の開発に向けた知識基盤を作りたいと考えています。
③生体外での器官の創出と加齢性疾患の治療・予防への応用に向けた基盤技術の開発(小池グループ)
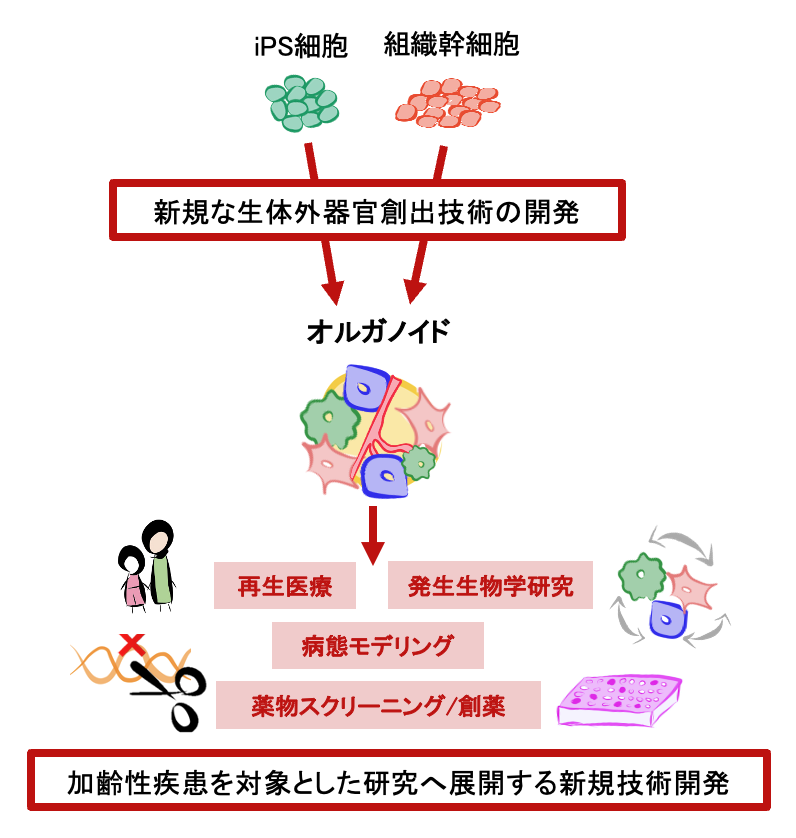
ヒトiPS細胞などの多能性幹細胞は、高い分化能力を有し、さまざまな細胞に分化することが可能です。組織幹細胞は、各組織の細胞を補充したり修復する役割を持つ細胞です。近年、これらの幹細胞を用いて、オルガノイドと呼ばれる小型で機能的な器官を生体外で構築する研究が盛んに行われています。オルガノイドは、培養液中で自己組織化することを特徴とし、特に私たちが作るオルガノイドは、複数の細胞系譜から構築されているため、生体内の臓器の構造や多様な細胞機能を再現しております。すでに、私たちは肝臓などの発生過程を再現した多臓器からなる消化器系オルガノイドや組織再生過程を再現した骨格筋オルガノイドを作製することに成功しています。こうしたオルガノイドは、生体内では観察が困難な現象の解析や、再生医療や薬剤スクリーニングへの応用などに用いられます。私たちは、オルガノイドをはじめとする生体外での器官創出法は、さらなる改良により、利用範囲を拡大することが可能であると考え、新規な手法でオルガノイド技術を開発するとともに、応用例の一つとして、加齢性疾患の治療・予防の技術開発へ展開することを試みています。

