革新診療技術開発ユニットは本学の技術・知財を有機的に統合することで、難治疾患の診断技術・治療法を開発することを目的とします。
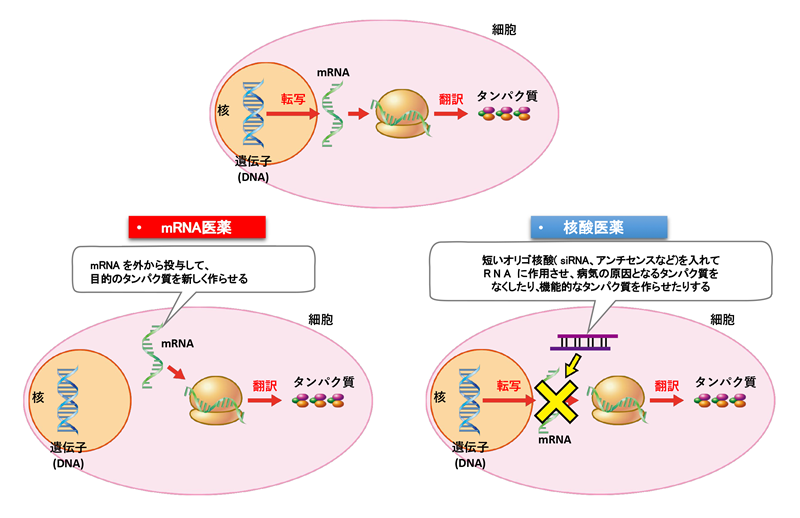
本ユニットが開発のターゲットとする核酸医薬は2017年に脊髄性筋萎縮症に対してヌシネルセン、2019年に家族性アミロイドポリニューロパチーに対してパチシランが日本においても認可されるなど、核酸医薬によってこれまで難治とされてきた疾患の根本治療薬として患者の元に届く時代が到来しています。本ユニットが有する新しい基盤技術に基づいて本学の未来医療コンソーシアム発の診断技術・治療法となることを目指して、研究を進めてまいります。
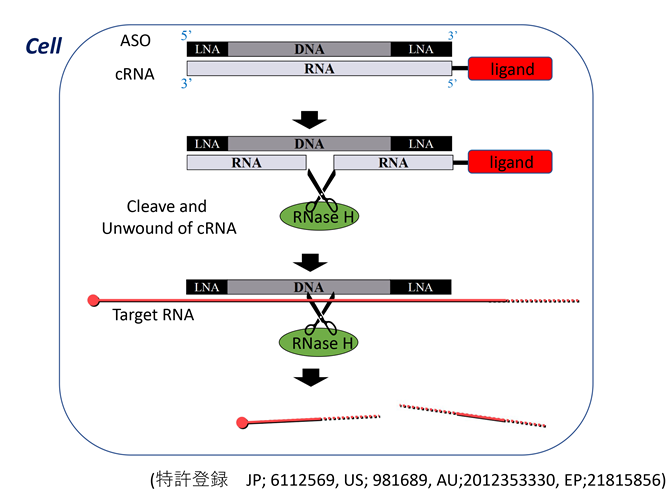
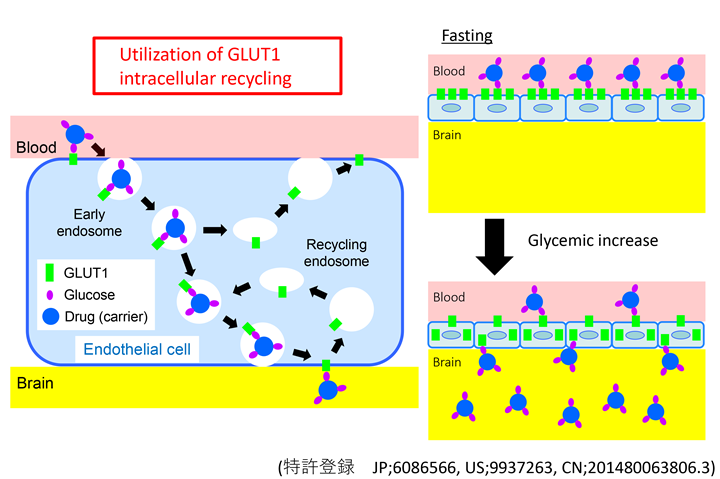
とりわけヘテロ核酸医薬、血液脳関門通過技術、mRNAナノミセル医薬は革新的ゲノム機能制御技術であり、ヘテロ核酸医薬知財は本学発のベンチャー企業としてレナセラピューティックス社、血液脳関門通過技術はブレイゾンセラピューティックス社に、mRNAナノミセル医薬はアキュルナに基盤特許が移転されています。これらの分子技術によって低分子医薬など従来アプローチできなかった疾患の根本治療となりうる可能性が期待されています。特にヘテロ核酸は日米の大手製薬会社やバイオベンチャーにライセンシングされました。
これらの技術はがん・免疫異常症・難治循環器疾患など、未来医療コンソーシアムの応用研究拠点ユニットが対象とするすべての疾患の変異遺伝子解析などの診断技術としても応用可能であります。またヘテロ核酸医薬、血液脳関門通過技術、mRNAナノミセル医薬は細胞内を含めた分子レベルで遺伝子を制御することで疾患の治療を可能とする技術であるため、これらの疾患の治療法開発のため、技術供与が可能であり、未来医療コンソーシアムの基盤技術として広く役に立つ技術を提供できます。
ヘテロ核酸医薬・mRNAナノミセル医薬などの本学が有する知財は欧米企業も類似特許を公開するなど、本学の優位性は予断を許しません。知財補強や、さらなる基盤技術の高性能化・新規要素技術の導入を実施し知財基盤を確保しながら、これらの技術を患者のもとに届けるために技術革新・応用を進めます。