1.水の性質 2.モノマーとポリマー 3.タンパク質 4.核酸 関連するサイトとリンク(このページへ戻るときはブラウザーの戻るを選んでください) 更新日:2003/04/07
生物を構成している元素は、地球上の物質を構成している元素と何ら異なることはない。化学で学んできたこと、これから学ぶことが、生物学を理解するための基礎となる。
化学の詳しいことは、化学科のおこなう講義や実習に任せることにして、ここでは生物学を学ぶために必要な、最低限のことを学ぶことにする。
生体を構成している分子の中で、割合が一番多いのは「水」である。
生体に占める水の割合はおよそ70%で、90%を越える場合もある。すでに、4)生物が生きていけるのは分子間の相互作用による機能のおかげである、と書いたが、この相互作用は水という媒質の中で起こるのである。
そのため、水分子の性質を理解するのきわめて重要である。水分子は地球上、どこにでもあるきわめてふつうの分子だが、非常に特異な性質を持っている。生物が生きていくためには、この特異な性質がきわめて重要なのである。
水分子の特異な性質は何だろうか。それは、水分子が分極していること、水分子同士が水素結合によって結合できることである。


http://www.sbu.ac.uk/water/molecule.html
http://www.aquadyntech.com/watermolecule.html
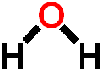
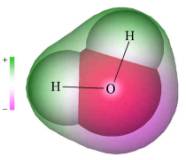
水の分子式はH2Oだが、H原子は上の図に示すように酸素原子の反対側に位置(180度)するのではなく、およそ105度の角度をなして酸素原子と結合している。さらに酸素原子が電子を吸引するために、2つの水素原子は正に帯電し、酸素原子は負に帯電している。
このため水分子全体としては極性のあるダイポール構造をしていること、正の水素原子が負の酸素原子と弱い結合をつくり、ちょうど間に水素原子を介して2つの酸素原子が結合するかたちとなる。この結合を水素結合(hydrogen bond)と呼んでいる。
水素結合は弱い結合なので、できたり壊れたりするが、この弱い水素結合で水分子全体が大きな結晶を作っているようなかたちとなる。
H+−O−---H+−O−−H+
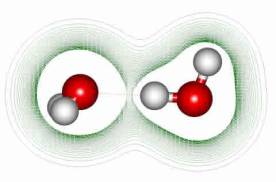
水分子のこのような性質のために、分子量が小さいにもかかわらず水分子はきわめて粘性が高く、また沸点も氷点も高い。
一方、この正と負に帯電した水素原子と酸素原子が、タンパク質分子などの表面の電荷を帯びた原子群と水素結合をつくるので、水は電荷を帯びた大きな分子を溶かす、良好な溶媒となる。
水を除いたあとに残る、生体を構成する基本的な要素は、タンパク質(protein)、核酸(nucleic acid)、多糖類(polysaccharide)、脂質(lipid)である。
これらの分子は、いずれも生体内ではポリマーとして存在する(脂質はちょっと違うが)。
ポリマーというのは、構成単位(モノマー)が共有結合で結合してつくられる、大きな分子のことである。高校の化学でナイロンとかポリエチレンとかを学んだことがあるだろう。ポリエチレンは名前が示す通り、エチレンを単位(モノマー)とするポリマーである。
○=モノマー、 ○○○○○○○○○・・・・・・・○○=ポリマー
ポリマーにモノマーが付加されてさらに長さが伸びていく。生体成分のポリマーの場合は、ポリマーと付加されるモノマーの間で水が取れて共有結合が作られる。
H−○○○○○○○○・・・・・・・○○−OH +H−○−OH
→ H−○○○○○○○○・・・・・・・○○○−OH+HOH(=H2O)
分解は加水分解(hydrolysis)による。
多糖類は単糖類とその誘導体をモノマーとするポリマーであり、脂質はグリセロール(三価のアルコール)と脂肪酸のエステルである。 ここでは、これからの話のために、タンパク質と核酸の構造について、もう少し学んでおこう。
1)タンパク質はアミノ酸のポリマー
タンパク質はアミノ酸をモノマーとするポリマーである。
アミノ酸分子の中心は炭素原子Cであり、ちょうど正四面体の重心にCが在り、各頂点に向かって4本の手(結合価)が伸びていると考えることができる。
このうちの2本には、それぞれアミノ基とカルボキシル基が結合している。残りの2本の手のうち、1本には水素が結合し、残りの1本にはさまざまな分子群R(官能基という)が結合する。
このさまざまな官能基が20種類あるので、アミノ酸は20種類あるのである。 つまり、下記に示すアミノ酸の基本構造のうち、R以外はすべて共通で、Rに20種類あるということである。
NH2−CH(・R)−COOH
このアミノ基とカルボキシル基は酵素の働きで結合することができ(脱水縮合)、この結合は特にペプチド結合と呼ばれる。もちろん、自分自身のアミノ基とカルボキシル基が結合するのではなく、2つのアミノ酸が並んだとき、隣り合ったカルボキシル基と次のアミノ酸のアミノ基が結合する。
NH2−CH(・R1)−COOH + NH2−CH(・R2)−COOH
→ NH2−CH(・R1)−CONH−CH(・R2)−COOH
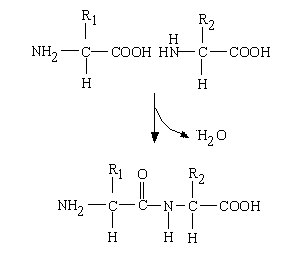
隣り合ったアミノ酸が、こうして次々とペプチド結合を作ってできた、鎖状につながった大きな分子がタンパク質(ポリペプチド)である。
本物の長い鎖を思い浮かべて、一つ一つの鎖の環がアミノ酸と考えればいい。ただ本物の鎖と異なるのは、一つ一つの環からRが飛び出た格好になる。
タンパク質を構成するアミノ酸は遊離アミノ酸とは異なるので、アミノ酸残基(amino acid residue)という。
NH2−CH(・R1)−CONH−CH(・R2)−CONH−CH(・R3)−CONH−CH(・R4)−CO−・・・・・・・・・・・・・・・−NH−CH(・Rn-1)−CONH−CH(・Rn)−COOH
2)タンパク質の一次構造
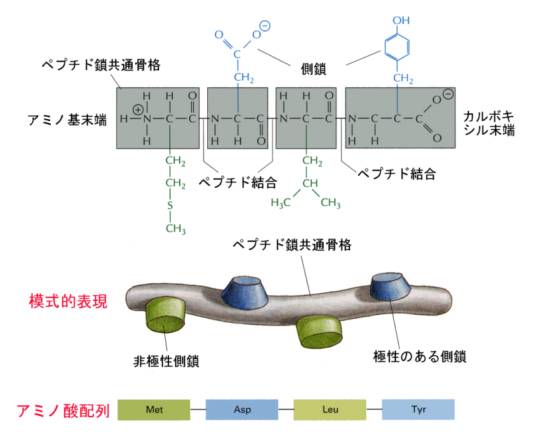
上に述べたように、タンパク質はアミノ酸が一列に並んでペプチド結合でつなぎ合わさった分子である。アミノ酸の並び方(配列、sequence)をタンパク質の一次構造(primary
structure)と呼ぶ。
上の分子式にあるように、ふつうはアミノ基側(N端)を左に書き、カルボキシル基側(C端)に向かって、アミノ酸に順番に番号を振っていく。したがってN端からC端に向かう方向性があることになる。
本物の鎖と同じように、鎖の環の部分は共通で、Rだけが異なる。
20種あるRは、大きさが異なるだけでなく、水に溶けやすい性質(極性、親水性)のものと溶けにくい性質(非極性、疎水性)のものがある。この大きさと水に対するふるまいの異なる組み合わせを持った20種類のRの並び方が、そのタンパク質全体のかたちと性質を決めている。
一番初めに一次構造が決められたタンパク質はインシュリンである。インシュリンは2本のポリペプチド鎖の途中にあるシステイン残基がジスルフィド結合(S−S結合)をつくって連結している。
3)タンパク質の二次構造
ペプチド結合を作っている>C=Oと>NHは、Oが負に帯電しHが正に帯電しているので、両者の間で水素結合を作る可能性がある。この水素結合によって形成される部分的な規則的繰り返し構造を二次構造(secondary
structure)という。
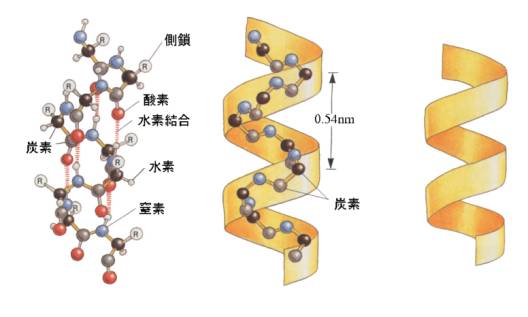
二次構造として代表的なものはαヘリックス構造とβシート構造である。
αヘリックスは、共通骨格構造部分が3.6アミノ酸残基ごとに1回転するラセン構造をしている。あるアミノ酸残基の>NHの水素原子が、3つ先のアミノ酸残基の>COの酸素原子と水素結合を作る。
αヘリックスは共通骨格構造がラセンを描いて形成されたリボン状構造から、Rが外側に突き出した構造をしている。そのため、αヘリックスをリボンで模式的に描いたり、もっと単純化して円筒形で描くことがある。
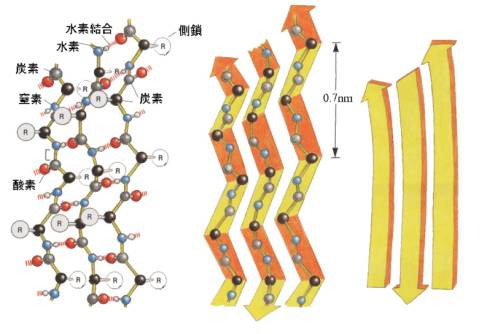
βシート構造は、ポリペプチド鎖が伸びた構造で、隣り合った鎖の間で水素結合が形成される。そのため、面積をもったシート状になる。
隣り合うポリペプチド鎖の向きが反対の逆平行β構造と、同じ向きの平行βシート構造がある。下の図は逆平行の例。
二次構造をつくるか、つくった場合にαヘリックスになるかβシートになるかは、側鎖の種類による。
プロリンは側鎖分子内で環状構造をとるため、水素結合をつくることができない。また、グリシンは側鎖がHと小さすぎるので、αへリックスが形成されにくい。したがって、プロリンやグリシンがポリペプチド鎖内にあると、その部分で二次構造が作られなくなり、タンパク質分子の表面に出ることが多くなる。
3)タンパク質の三次構造、四次構造
タンパク質分子の全長にわたって、上に述べたαヘリックスとβシート構造が形成されるのではなく、両者とそれをつなぐ部分(ランダムコイルと呼ぶ)があって、分子全体として立体的な構造をとる。これをタンパク質の三次構造という。
三次構造が作られることによって、アミノ酸配列では離れていたアミノ酸残基の側鎖が近づくことができる。
三次構造が作られるのは、親水性の側鎖は表面に向き疎水性側鎖は分子の内側に向くためと、分子内の相互作用によっている。
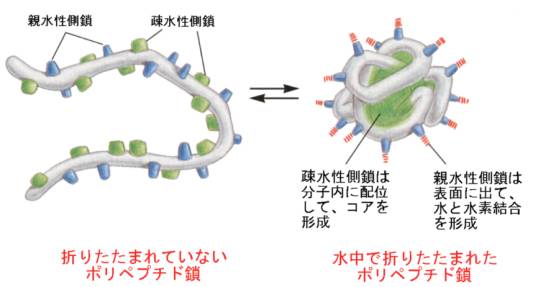
立体構造ができるために、タンパク質の表面にはでっぱりや凹み(ポケット)ができる。また、配列の上からは遠く離れていたアミノ酸残基が近づくことで、機能的なスポットが形成される。
このような立体構造が、タンパク質が機能をあらわすためには重要で、立体構造が熱などによって壊れると、機能を表さなくなることがよくある。
これまではN末端からC末端まで一続きのポリペプチド鎖を主に考えてきたが、タンパク質のなかには、このような一塊のポリペプチド鎖が複数個、非共有結合によって集合体をつくっている場合がある。このような構造をタンパク質の四次構造という。
たとえば有名な例はヘモグロビンで、ヘモグロビンは2つづつ同じ構造のポリペプチド4つの単位が集合してできたタンパク質である。このような場合、単位となる個々のポリペプチドをサブユニットと呼んでいる。四次構造を作ることで、タンパク質はさらに複雑な形を取ることができ、新たな機能を獲得する。
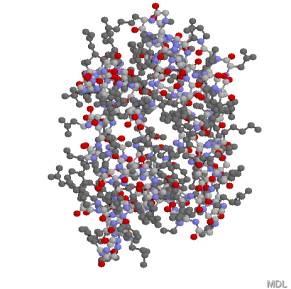
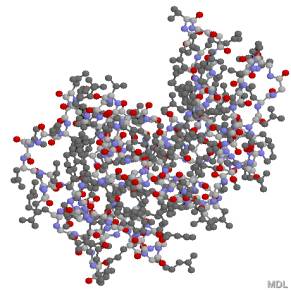
別の方向から見た、卵白リゾチームという酵素の三次構造(Ball
& Stick)
薄い灰色:炭素、赤:酸素、青:窒素、濃い灰色:側鎖。水素は省略してある。
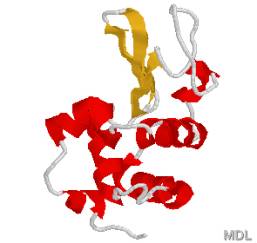
上図の右側をリボンと矢印で表示したリゾチーム
赤はαヘリックス、黄色は逆平行βシート、灰色の棒はランダムコイル
4)タンパク質のはたらき
タンパク質は生物の機能を担う分子である。この機能は、タンパク質表面のポケットなどの形と、その形に付随した特定のアミノ酸側鎖の性質によっている。
タンパク質の主な機能を列挙すると次の表のようになる。
|
種類 |
役割 |
例 |
|
構造タンパク質 |
支持 |
コラーゲンやエラスティンのように組織の形を保つ。ケラチンのように毛髪や爪をつくる |
|
貯蔵タンパク質 |
アミノ酸の貯蔵 |
卵白のオボアルブミンやミルクタンパク質のカゼイン |
|
運搬タンパク質 |
物質の運搬 |
ヘモグロビンは酸素を運搬 |
|
ホルモンタンパク質 |
ホルモンとして生体の調節 |
インシュリンのようにホルモンとしてはたらく |
|
受容体タンパク質 |
信号分子を受取る |
ホルモンなどの信号分子と結合して信号を細胞に伝える |
|
収縮タンパク質 |
細胞運動 |
アクチンとミオシンは筋収縮をになうタンパク質 |
|
防御タンパク質 |
病気から生体を防御 |
抗体は細菌やウイルスに対抗する |
|
酵素タンパク質 |
化学反応を選択的に促進 |
消化酵素は食物を分解。細胞内のあらゆる化学反応を触媒する |
さらに学びたい人は次のページも参照してください。
http://www.tmd.ac.jp/artsci/biol/textbook/celltop.htm
核酸はヌクレオチドをモノマーとするポリマーである。
ヌクレオチドは、五単糖(リボースあるいはデオキシリボース)、リン酸、核酸塩基からできている。
核酸にはデオキシリボ核酸(DNA)とリボ核酸(RNA)の二種類があるが、DNAを構成するヌクレオチドの糖はデオキシリボースで、RNAはリボースである。いまDNAのほうだけを考えることにする。
1)DNAの構造
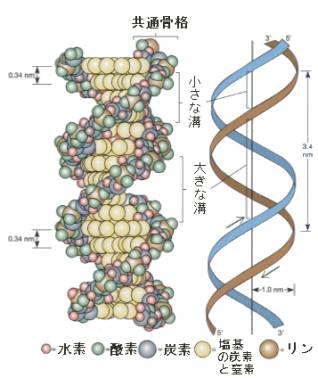
DNAにもアミノ酸の場合と同じように共通骨格がある。
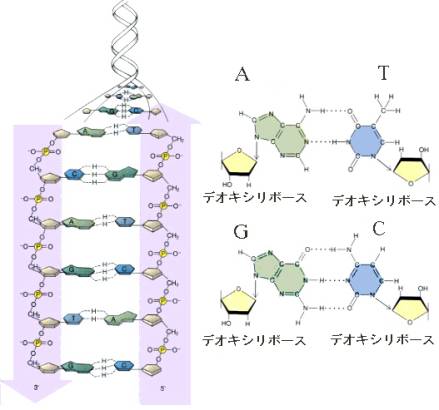
DNAの場合は、共通骨格は糖(デオキシリボース)とリン酸で構成され、この共通骨格の糖の部分から塩基がつきでた形をしている。
塩基には4種類あり、略称で書くと、AGCTである。詳しいことは省略するが、この共通骨格にも5'末端から3'末端に向かう方向性がある。
DNAは、こうしてできた2本のポリヌクレオチド鎖が逆平行に寄り添い、つきでた塩基の間に水素結合が作られて結合した、二本鎖の分子である。水素結合によって結合できる塩基の君合わせは決まっていて、AとTの間には2本、GとCの間には3本の水素結合ができ、この組み合わせでしか水素結合はできない。
塩基は平面状の分子で、AとT、GとCはそれぞれ向きき合って結合するため、塩基のペアは梯子のステップのように平面で、これが何段も積み重なった構造となる。
二本のポリヌクレオチドの鎖は、塩基のペアをはさみながらラセン構造をとる。大きな溝と小さな溝が交互にくる、いわゆる二重ラセン構造である。DNAの場合は、タンパク質の場合と異なり、この構造しかとらない。ある意味では単純である。そのため比較的安定な構造となる(そのため古い組織などからDNAを取り出すことができる)。
2)DNAのはたらき
DNAのはたらきは、ひとえに遺伝情報の蓄積である。
DNAがはたらくときは、ヌクレオチド鎖の片方だけが必要となる。大切なことはヌクレオチド鎖には5’から3’への方向性があり、塩基が直線状に配列しているということである。すなわち重要なのは塩基の配列(sequence)である。
DNAの塩基には4種類あると書いたが、この4種類の文字3つづつの組み合わせが、20種類あるアミノ酸をコードしている。
つまり、DNAの塩基配列がタンパク質のアミノ酸の配列を決めているのである。
さらに学びたい人は次のページも参照してください。
http://www.tmd.ac.jp/artsci/biol/textbook/celltop.htm
![]() この章のpdfファイルをダウンロードするには、左の「Adobe」のアイコンを右クリックして、ファイルを保存を選んで、自分のパソコンにダウンロードしてください。
この章のpdfファイルをダウンロードするには、左の「Adobe」のアイコンを右クリックして、ファイルを保存を選んで、自分のパソコンにダウンロードしてください。
![]() ブロードバンド接続の場合で、ワードのファイルを望む人は、「W」のアイコンを右クリックしてください。
ブロードバンド接続の場合で、ワードのファイルを望む人は、「W」のアイコンを右クリックしてください。