1.はじめに 2.細胞骨格分子の種類 3.微小繊維(actin filament) 4.微小管(microtubule) 5.中間径繊維 6.細胞運動 1)繊毛打(ciliary movement) 2)鞭毛モーター 3)筋収縮 更新日:2002/04/08
細胞が一定の形を保っていられるのは、細胞骨格のおかげである。
細胞骨格と言うと固いものを想像してしまうが、決してそうではない。むしろもっと自由度が高い。ビーズをたくさん通したネックレスのようなものを想像してほしい。真ん中の糸を持ってビーズを一方に押しつけると結構しっかりした棒になり、緩めると自由に折れ曲がる、そんな感じである。
細胞の中には、これらの細胞骨格分子(いずれもたんぱく質)が張り巡らされている。そのために、形を保つこともできるし、細胞運動を行うこともできる。
細胞骨格分子には次のようなものがある。


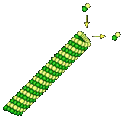
いずれの分子も、サブユニットタンパク質が連なった形をしている。微小繊維や微小管は、球状タンパク質の一端に結合部位、反対側に受容部位が存在するような形をしていて、次々と一列につながっている。
微小繊維や微小管では、これらのサブユニットが恒久的に結合しているのではなく、繊維の両端で常に会合(assemble)と解離(disassemble)がおこっ ている(上の図参照)。ところがこの速度が一端と他端で異なるために、長さを変えることができる。そのために方向性が生ずる。伸びて行く方向をプラスエンドと呼ぶ。
一端が他のタンパク質、たとえば細胞裏打ち構造や中心体と結合して、会合、解離が安定化されていることがある。
関連するサイトとリンク(このページへ戻るときはブラウザーの戻るを選んでください)
Biology467 (Biology
467 Biochemistry, Cell and Molecular Biology III Spring 2001)
微小繊維は、球状タンパク質であるアクチン分子(G−アクチン)が連なってできた繊維(F−アクチン)が2本、撚り合わさった形をしている。
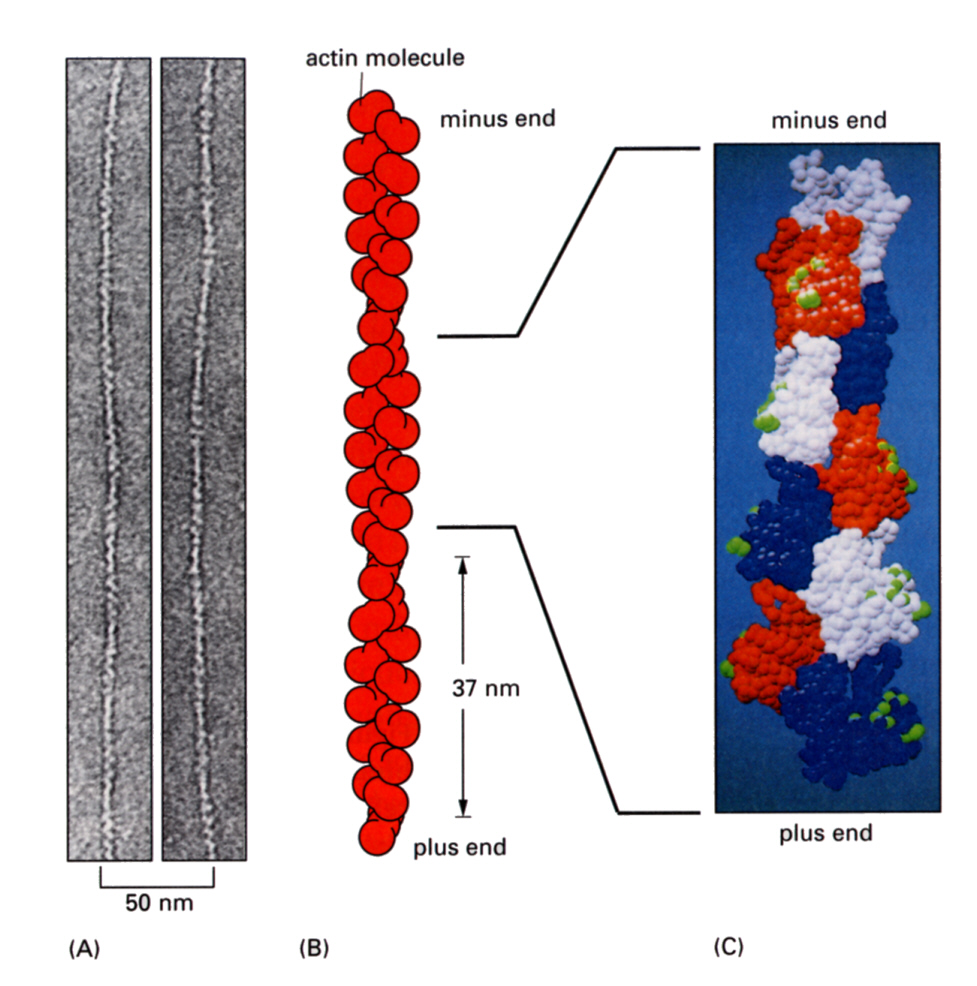
(A)ネガティブ染色した微小繊維の電子顕微鏡写真 (B)微小繊維中の
アクチン分子の並び方 (C)アクチン分子を色分けして隣同士密着していることを示す
アクチン分子は、375個のアミノ酸からなる1本のポリペプチドである(下図左)。下の図で、帯が巻いたようになっている部分はαヘリックス構造、矢印部分はβシート構造をあらわす。真ん中の深い切れ込みの左右で、分子は2つのドメインにわかれる。アクチン分子はこの切れ込みに1個のATPを抱え込んで強く結合している。
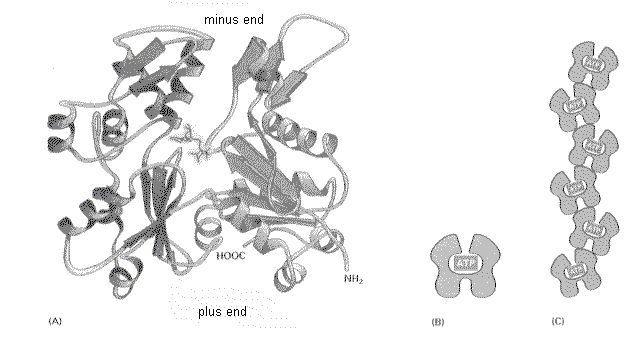
(B)はこれを模式的にあらわしたものである。(C)はこのモノマーがつながった様子を模式的に示している。
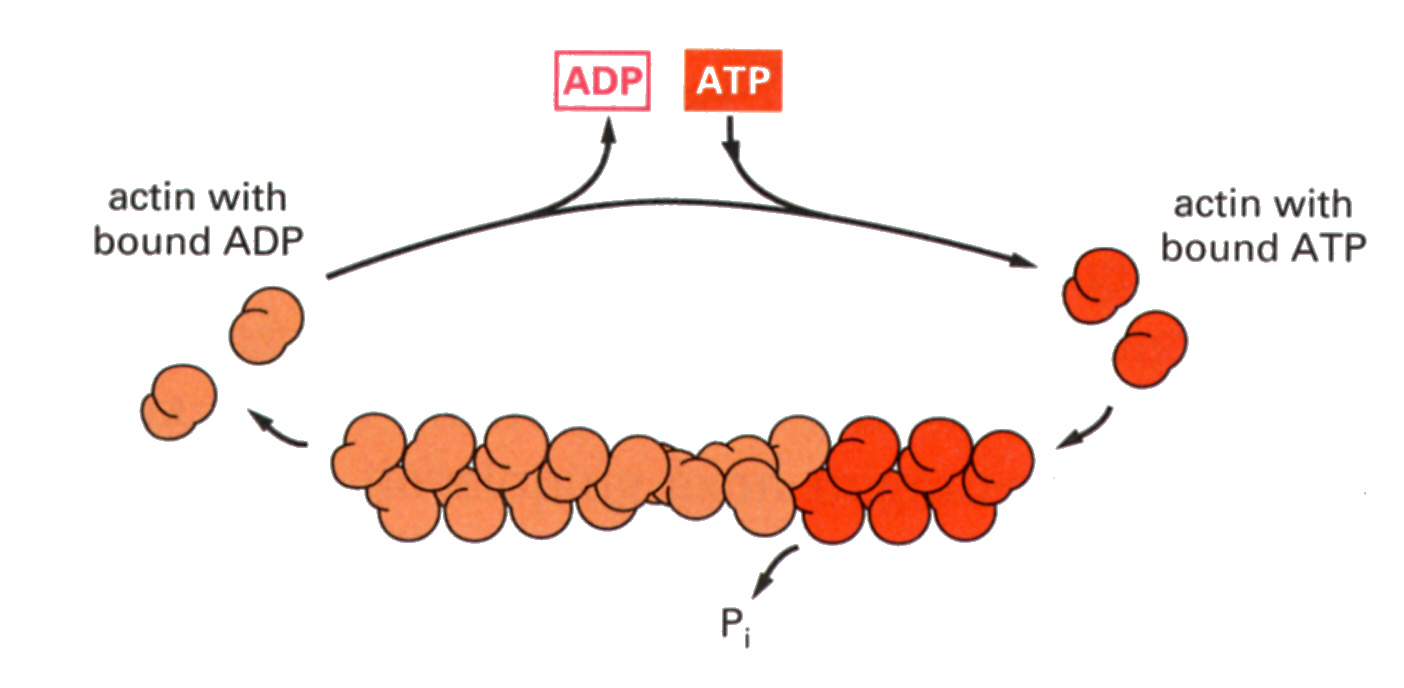
会合はプラスエンドと書いてある端で強くおこり、反対のマイナスエ ンドではほとんどおこらない。このダイナミックな会合と解離には、ATPとその加水分解によるADPへの変換が関与している。
モノマーではATPと結合して会合しやすくなり、ポリマーになるとATPはADPに加水分解され解離しやすくなる。ただしフィラメントの途中では解離できない。解離するとADPは切れ込みから解放され、ATPと置き換わり、再び会合できるようになる。
このようなダイナミックな解離と会合が細胞表層の微小繊維の束でおこっているために、細胞が小突起を出したり引っ込めたりすることができるのである(下の図C)。
アクチンの会合を阻害する物質に、菌の一種から単離されたサイトカラシンがあり、これを使って細胞運動の研究が行われている。サイトカラシンによって影響を受ける細胞運動には、次のようなものがある。
収縮環による細胞質分裂(阻害によって核分裂はおこるが細胞質がくびれない、下の図Dは正常な場合)
卵割の進行
初期発生でおこる原腸陥入
神経の軸索の成長
白血球の食作用
など。
したがって、これらの過程には微小繊維の形成が深く関わっている。
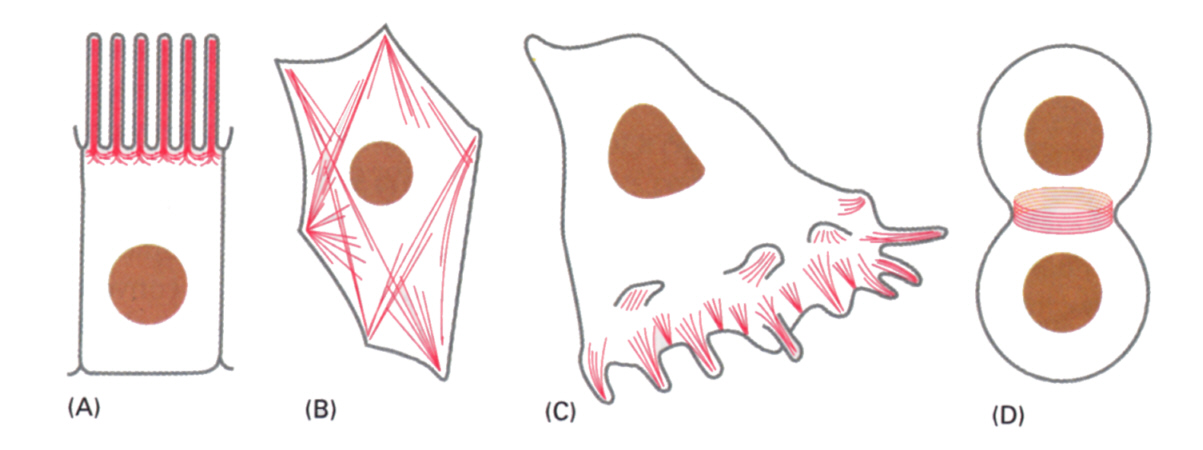
(A)微絨毛 (B)細胞質の収縮性の束 (C)移動する細胞の先端にできる葉状仮足と糸状仮足
(D)細胞分裂時の収縮環
アクチンと結合することができるタンパク質がたくさんある。これらのタンパク質によって微小繊維はお互いに結合しあったり、細胞膜と結合したり、向き合って滑り込んだりすることができる。微小繊維に結合できるタンパク質で重要なのは、ミオシンである。ミオシンはアクチン上をATPのエネルギーを使って動いていくモータータンパク質である。
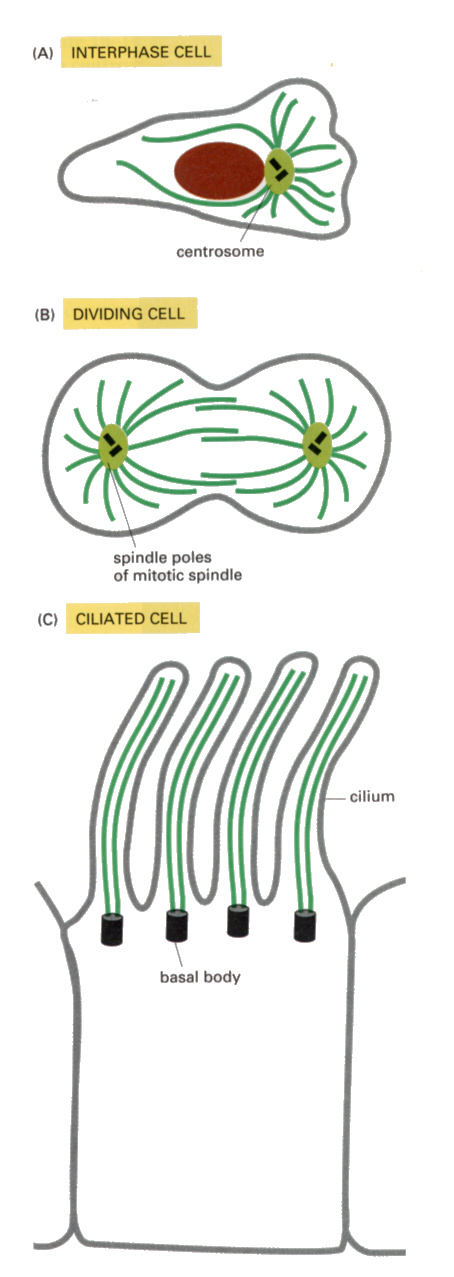
微小管は、中心体(centrosome)から細胞周辺にネットワークのように延びた細胞骨格分子である。細胞小器官(organella)は、後で述べるモータータンパク質を介してこのマイクロチュービュールと結合し、いろいろな場所へ移動して行く。また、魚類の色素細胞で見られるように、顆粒の運動に関係している。繊毛(cilium)や鞭毛(flagella)の中を貫いていて、その運動に関係する。さらに、細胞分裂のときの紡錘糸(spindle fiber)として、核分裂に関与する。
微小管は、互いによく似た球状タンパク質であるαチュービュリンとβチュービュリンが交互に会合した中空の繊維がである。断面を見ると一回り13個のチュービュリン分子からなる。すなわち13本の原繊維(protofilament)が寄り添った形になる。
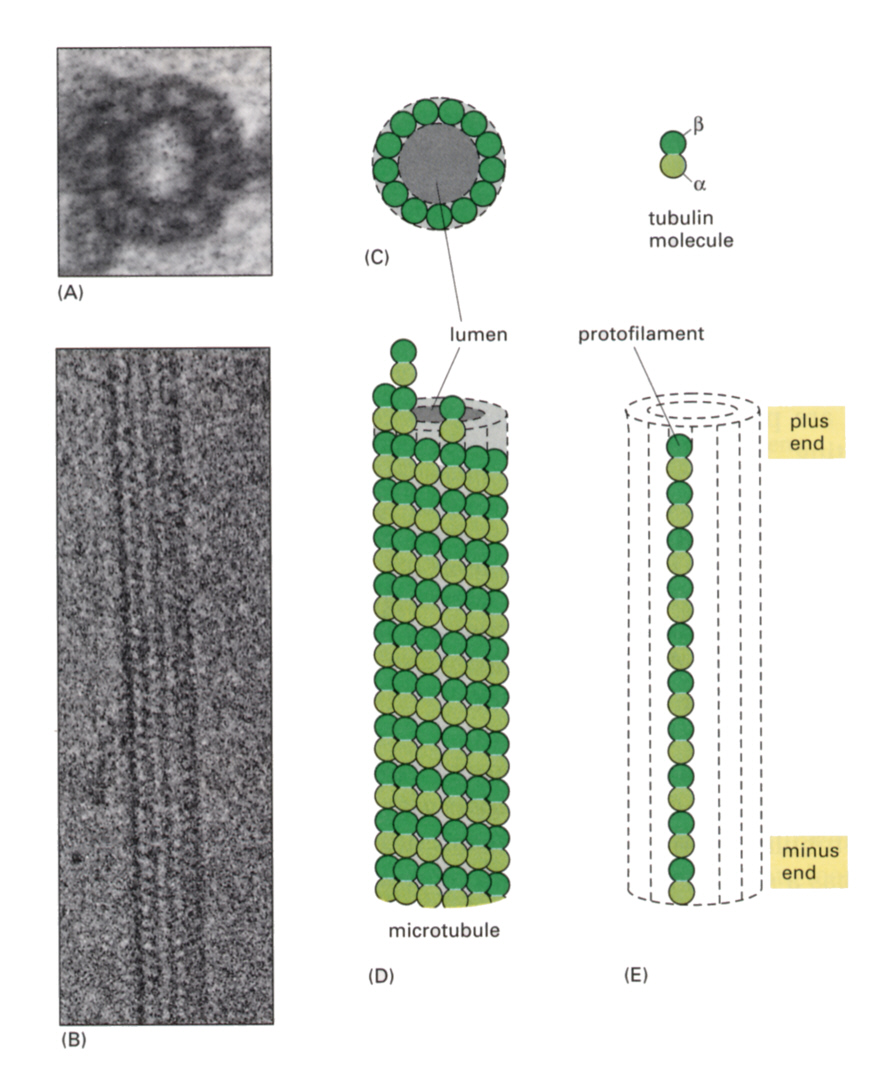
微小繊維と同じように、会合と解離が両端でおこっていて、その速度が違うので方向性がある。ユリ科植物のイヌサフランの種子、鱗茎から抽出されるアルカロイドであるコルヒチンが、チュー ビュリンの会合を阻害する。
この薬品で処理すると、紡錘糸の形成が阻害され、そのために 核分裂がおこらない(種なしブドウ)。この会合と解離には、アクチンの場合のATPとは異なり、GTPが関与する。GTPはβサブユニットに結合して会合しやすくなる。
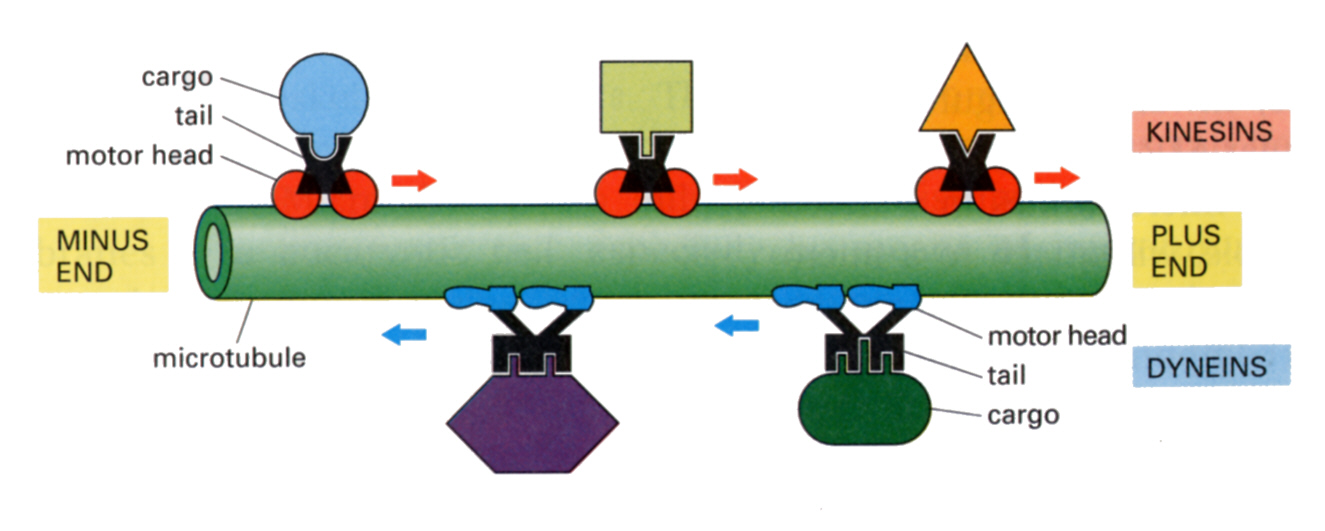
微小管にも結合タンパク質が存在する。よく知られているのは、ダイニン(dynein)とキネシン(kinesin)である。どちらもモータータンパク質と呼ばれ、下の図のように微小管の線路の上を、トロッコのように荷物を積んで動いて行く。両者の違いは走行方向である。ダイニンはマイナスエンドに向かって動き、キネシンはプラスエンドに向かって動く。もちろんこの動きにはATPのエネルギーが必要である。
関連するサイトとリンク(このページへ戻るときはブラウザーの戻るを選んでください)
東京大学大学院医学系研究科分子細胞生物学細胞生物学・解剖学大講座研究紹介
テキサス大学医学系大学院細胞生物学講座細胞生物学テキスト
中間径繊維は、前の2つの分子とは異なり、繊維状タンパク質をモノマーとする、強度があるロープのような繊維である。そのため、細胞の強度やテンションを保つのに重要な役割を持っている。
それぞれの組織に特有の中間径繊維があるが、主なものは次の通りである。
上皮細胞:ケラチンフィラメント
神経細胞:ニューロフィラメント
グリア細胞:グリアフィラメント
筋肉:デスミンフィラメント
繊維芽細胞:ビメンチンフィラメント
核の最内層: 核ラミンフィラメント
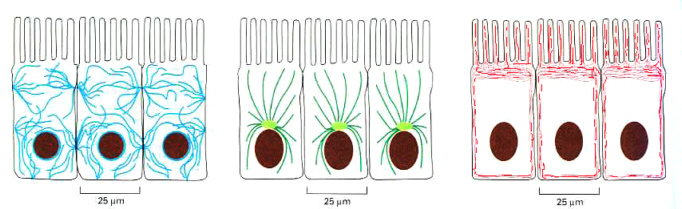
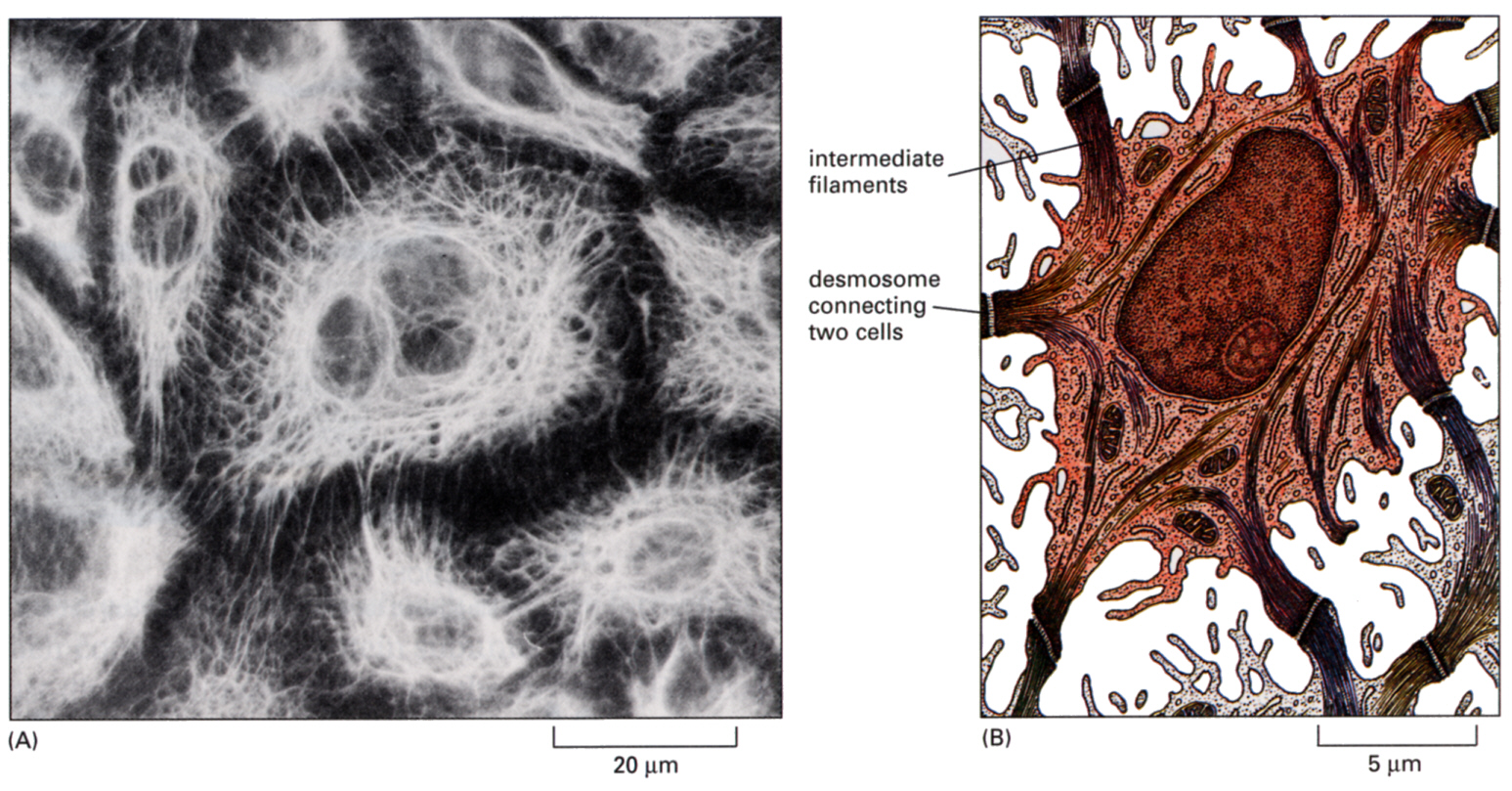
下の図は、上皮細胞のケラチンフィラメントを抗体に蛍光色素を標識して染め(免疫組織化学法、immunocytochemistry)、蛍光顕微鏡で見たものである。ケラチンフィラメントは、デスモゾーム(細胞膜参照)を介して隣の細胞と連続している。
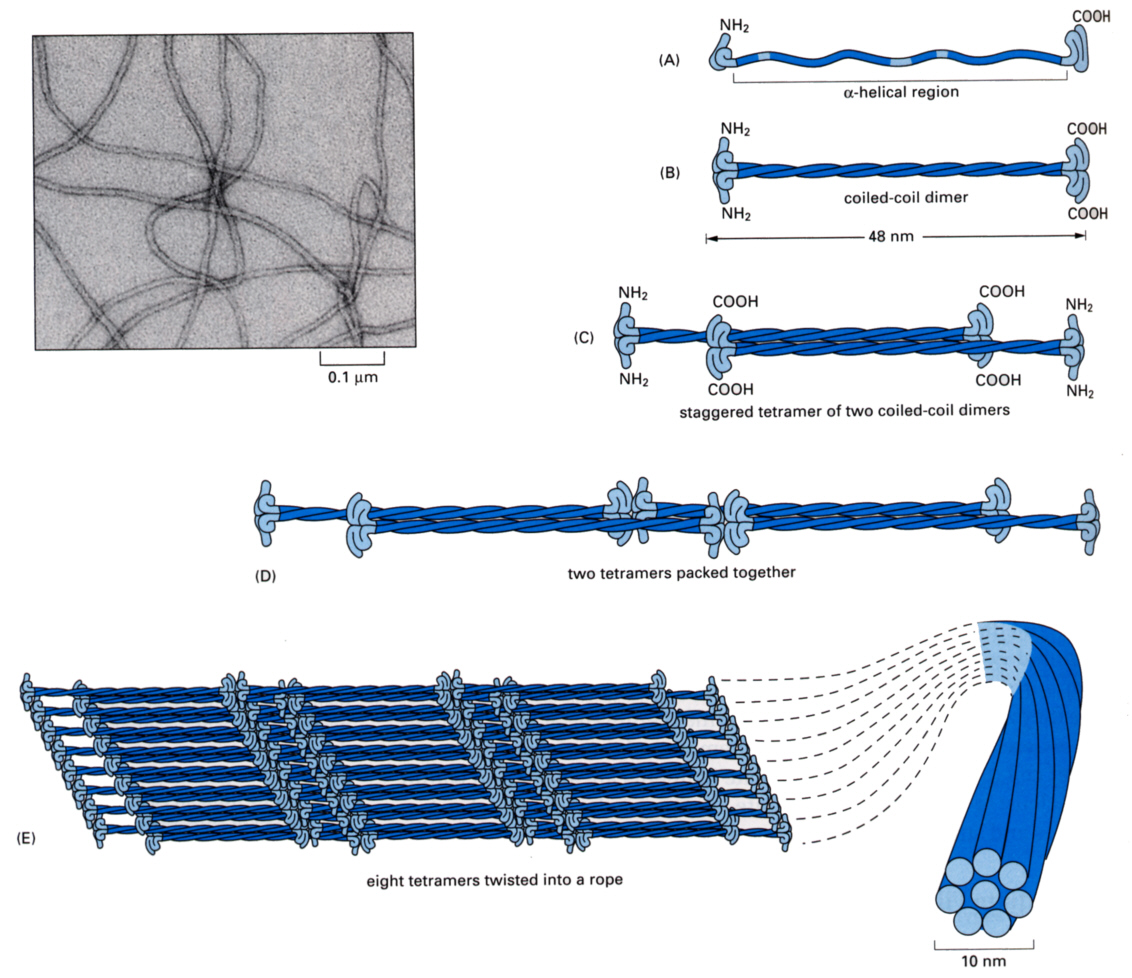
それぞれの繊維を構成するモノマーは、下の図のような構造をしている。
いずれのモノマー分子も、特定のアミノ酸配列の繰り返しを含むαヘリックス構造の棒の両端に、頭と尻尾をつけた構造をしている。このモノマーが2本、平行に撚り合わさってダイマーを作る(coiled coil dimer)(次図B)。ついでこのダイマーが逆平行(頭と尻尾を向き合わせて)(次図C)に会合してテトラマー(四量体)を作る。これが単位となり繰り返し構造で 繊維を作る。これが現在考えられている中間径繊維の構造である。
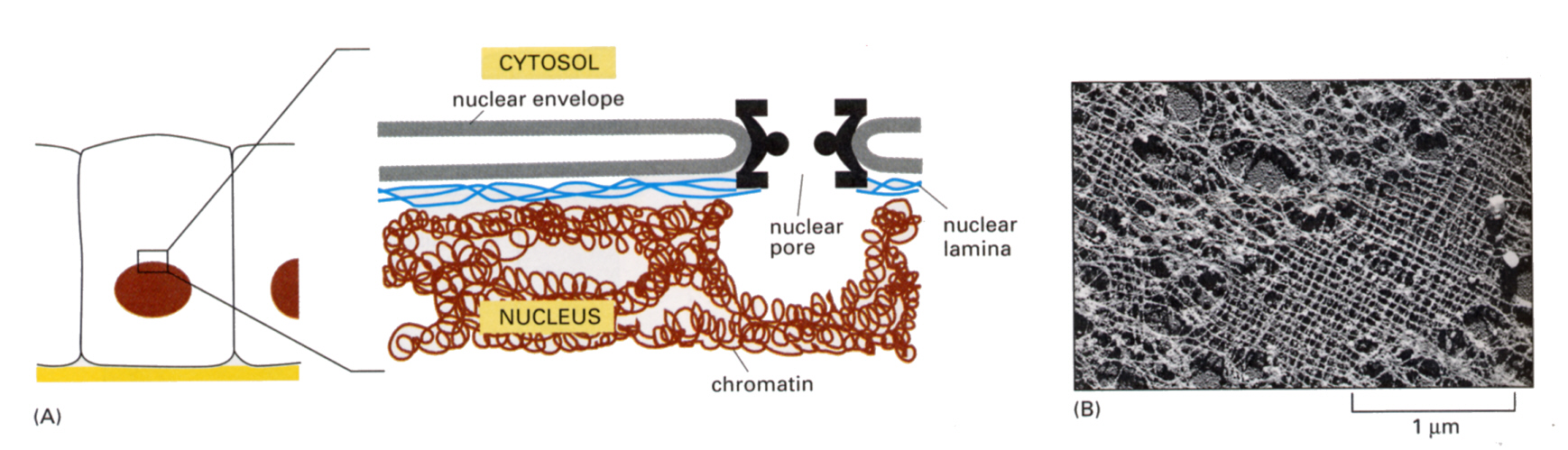
核ラミンフィラメントは、核膜のすぐ内側にあって格子構造をかたちづくり、核の形を保っている。核膜は細胞分裂のときは消失するので、この中間径繊維も核分裂のときは解離する。
1)繊毛打(ciliary movement)
ゾウリムシの体表には繊毛がはえていて、これを使ってゾウリムシは水中を泳ぐ。人でも気管の表面には無数の繊毛があって、規則的に繊毛打を繰り返している。
繊毛の断面を電子顕微鏡で観察すると下の図のような構造をしている。
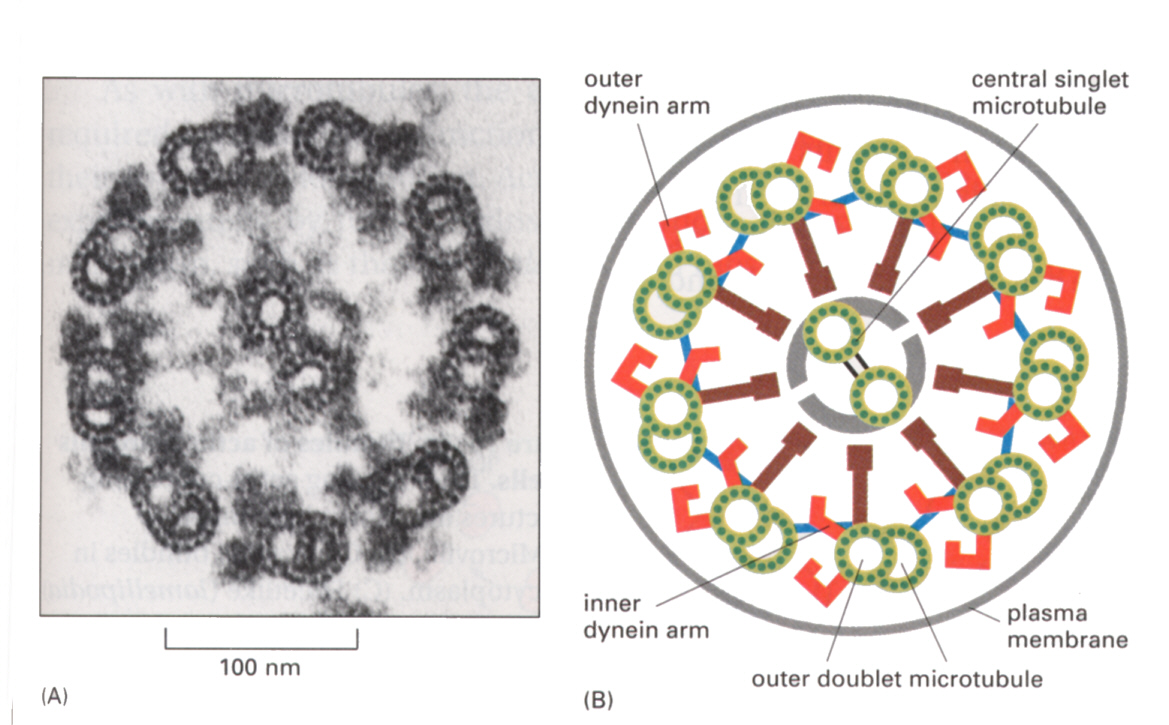
図を見てわかるように、中心に2本、周囲に9本の繊維(軸糸、axoneme)が見える(9+2構造)。周囲の9本はダブレット構造をしている。周囲の9本の軸糸からは2本のダイニ ンアームが時計周り方向に突き出している。その他のタンパク質は、軸糸を束ねたり、繊毛打を望ましい波形にするための機械的リレーシステムのために必要な結合タンパク質である。
それぞれの軸糸は微小管からできている。中心の2本は微小管そのものだが、ダブレット構造をした周辺の9本の軸糸は、原繊維13本のAチュービュールと11本のBチュービュールの2本の微小管が融合している。
鞭毛の構造は、基本的には繊毛と同じであるが、繊毛よりはるかに長く、細胞全体を動かすのに適している。精子の尾部が典型的な鞭毛である。
下の図は、ウニ精子の鞭毛運動を示している。Triton-Xという界面活性剤で細胞膜を処理して、大きな分子が鞭毛内に入れるようにして、ATPの溶液中で精子を泳がせて撮影した。泳がせる前に金粒子を向かい合う周辺の軸糸に結合させる処理をしてある。鞭毛の屈曲に伴って、金粒子(光る2点)間の距離が変化するのがわかるだろう。詳しくはBrokaw, C.J. (J. Cell Biol. 114, 1201-1215, 1991)を参照。(http://www.cco.caltech.edu/~brokawc/Demo1/BeadExpt.htmlより転載)

この動きは、モータータンパク質のところで説明した微小管とダイニンの相互作用でおこる。繊毛ではダイニンがダブレットのうちのAチュービュールと結合しており、突き出た腕の先端はBチュービュールとATP依存的に結合している。ATPが加水分解されてエネルギーが発生すると、ダイニンはBチュービュール上をマイナスエンド、すなわち基部の方に動いて行く。このために、屈曲がおこるのである。
屈曲がおこる様子を示す模式図(WindowMediaPlayer/0.8M)
2)鞭毛モーター
細菌の鞭毛は、真核生物の鞭毛とは異なっている。
細菌では、細胞膜に埋め込まれた軸受け部内でローターが回転することにより鞭毛が回転して、推進力が生ずる。回転数は毎秒40回転ほどである。
この回転のエネルギーはATPによってもたらされるものではなく、プ ロトンの濃度勾配を利用してモーターを駆動していることがわかっている。
真核生物ミトコ ンドリア内膜に存在する呼吸系タンパク質が、細菌では細胞膜に埋め込まれている。これによってプロトンの濃度差を細胞膜内外に作り、プロトンの移動によって鞭毛を回転させている。
3)筋収縮
筋細胞の構造
細胞内に一般的に存在する微小管が集まって繊毛を形成し、細胞運動の一つである繊毛打をおこしていたように、細胞に一般的な微小繊維とその結合タンパク質の一つであるミオシンが、組織的にかつ多量に集まって筋収縮をおこす。
多量に存在する筋肉のアクチンやミオシンの方が集めやすいので、研究の歴史は筋肉を対象として始まった。
下の図は骨格筋の筋細胞(=筋繊維)とそれを構成する筋原繊維(myofibril、1)の模式図である。筋細胞は筋繊維鞘(sarcolemma、5)で包まれた多核の細胞である(筋芽細胞 myoblastが融合したシンシチウムである)。筋原繊維を包んでいるのは筋小胞体(sarcoplasmic reticulum、2)である。筋原繊維は筋節(sarcomere)が多数、連なったような構造をしている。4:T管(T tubule)。
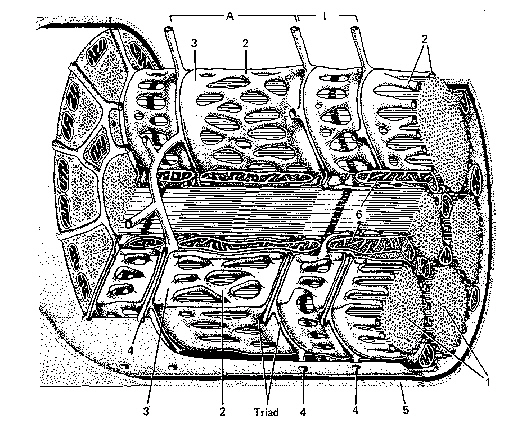
筋節の長さは約2.5μmで、細胞の長さの0.01 %にすぎないので、一つの筋細胞は10,000ほど の筋節を含むことになる。筋節の両端はZ線(Z板、ZL)で仕切られていて、次の筋節と連続し ている。
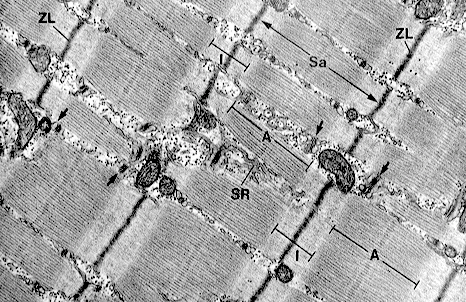
電子顕微鏡(下図)で見ると、筋節には多数の繊維構造が見える。筋節の中央部には電子顕微鏡で見て暗く見えるA帯(暗帯)が存在し、A帯とZ線の間は明るいI帯(明帯)が存在する。
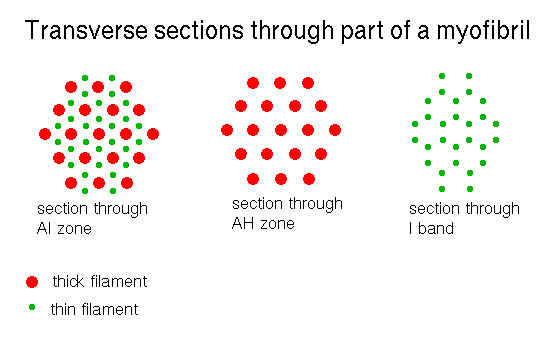
A帯の中央にはやや明るいH帯が存在する。筋節の断面を電子顕微鏡で見ると、 I帯は細いフィラメントのみ、A帯は細いフィラメントと太いフィラメントが規則正しく交互に配列し、H帯は細いフィラメントがなく太いフィラメントだけであることがわかる。SR:筋小胞体,Sa:筋節。
骨格筋では、最大収縮時には筋細胞の長さの約40%短くなる。このとき、すべての筋節の長さは一様に減少する。筋節の短縮により、Z線間の距離は縮まるが、中央のA帯の長さは変わらない。しかしながらH帯とI帯はほとんど消失する。
これは収縮に伴って細いフィラメントがA帯中に滑り込むことを意味する。完全収縮時には細いフィラメントが中央でほとんど出会うところまで滑り込む。
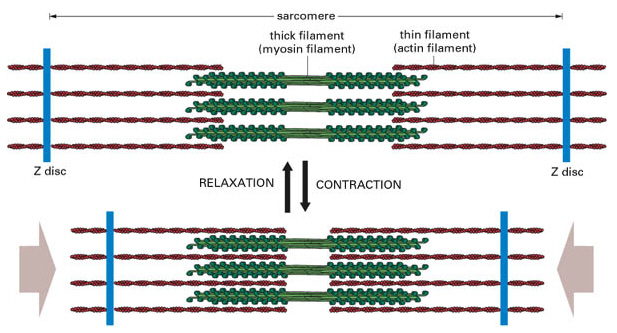
細いフィラメントは微小繊維と同じもので、これがZ線に強く結合している。
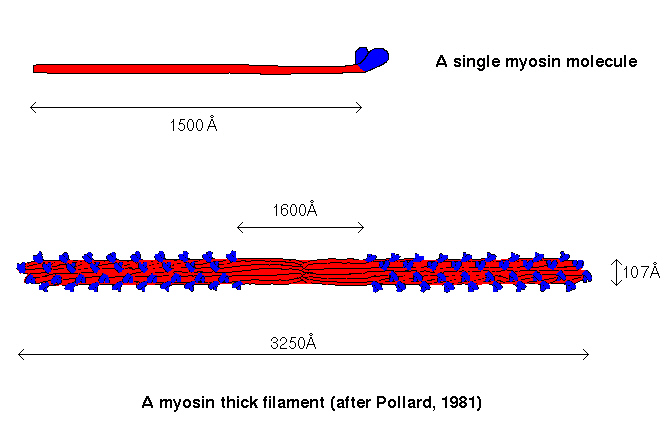
太いフィラメントはミオシン分子からなる。ミオシン分子は下の図のような構造をしている。 2本の相同な重鎖(分子量200,000でアミノ酸1,800からなる)と、4つの軽鎖からなる大き な分子である(分子量500,000)。
上の図からわかるように、頭の部分とそれに続く長い2本 のαヘリックスが撚り合わさった構造をしている。 ミオシンフィラメントは、このミ オシン分子が約500本、規則正しく集合してできている(下の図)。ミオシン分子の尾部は 平行に並び、アミノ酸残基の側鎖間の相互作用により側面どうしで結合する。
ミオシン分子の長さは、太いフィラメントの長さの一部にすぎないが、分子は下の 図のように互い違いに少しずつ、づれながら重合するので、尾部は太いフィラメントのコアを形成し、球状の頭部は コアの側面から規則的な間隔で突き出すかたちになる。
ミオシンフィラメントの中央の左右で、 ミオシン分子の頭部はそれぞれフィラメントの両端に向いて配列される。したがって中央部は ミオシン分子の頭部の突出がなく、電子顕微鏡で見るとH帯となって見える。
アクチンフィラメントとミオシンフィラメントは次の図のように配列している。これは一断面のごく一部の模式図で、このような配列が三次元的に広がっている。
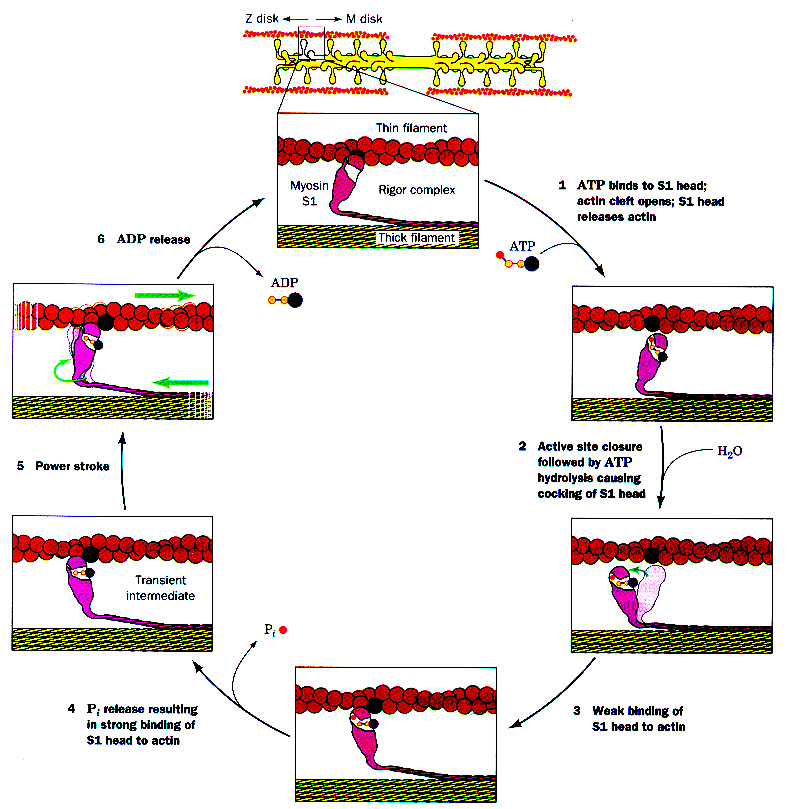
筋収縮の機構
それでは収縮はどのようにしておこるのだろうか。
ミオシン頭部にはアクチンとの結合部位とATP分解酵素の働きがある。はじめミオシン頭部はアクチンと結合しているとする。ATPがやってくると、ATPはミオシン頭部のATP分解酵素部位と結合する。
するとミオシン頭部は立体構造が変わるため、アクチンとの結合が外れ、フィラメントに沿ってプラスエンドに向かって移動する。一方、結合したATPはATP分解酵素の働きでADPとリン酸に分解 される。
するとミオシン頭部は移動した位置でアクチンと結合し、リン酸を放出してさらに 強くアクチンと結合する。
最後に、ミオシン頭部はADPを放してもとの姿勢に戻り、このときアクチンフィラメントを滑り込ませる。この運動を繰り返すことにより、アクチンフィ ラメントはA帯の中に滑り込んでゆき、筋節は短くなる、すなわち収縮がおこる。
筋収縮の開始
それではどうして収縮が始まるのだろうか。
骨格筋の場合、運動神経が興奮すると、その神経末端(正確には軸索の末端で、シナプスと呼ばれる構造)から神経伝達物質であるアセチルコリンが放出される。すると、筋小胞体に貯蔵されていたカルシウムイオンが筋繊維内に放出される。このカルシウムイオンの濃度が上がることが刺激になって、上に述べたATP によるミオシンの運動が始まる。
カルシウムイオンは、筋小胞体の膜に存在するポンプの働きによって元のように汲み込まれると筋肉の弛緩がおこる。このように、カルシウムイオンが運動の開始に極めて重要な役割を演じているのである。
それではカルシウムイオンの濃度が高くなるとどうして収縮が始まるのだろうか。この点を理解するためには、アクチン結合タンパク質について理解する必要がある。
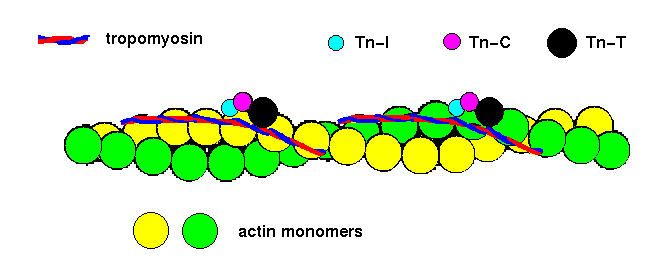
いままでは、筋肉のアクチンフィラメントを2本のFアクチンが撚り合わさった、とだけしか説明してこなかった。実際には、アクチンフィラメントに沿ってトロポミオシンという細長いタンパク質が巻きついていて、アクチンのミオシン結合部位をふさいでいる。
もう一つのアクチン結合タンパク質であるトロポニン複合体(Tn-I、Tn-C、Tn-T)はトロポミオシンと結合し、カルシウムとも結合できる。カルシウムイオンは、トロポニンと結合してその立体構造を変え、トロポミオシンをアクチンのミオシン結合部位から引き離す。そのため、上に述べたミオシンとアクチンの相互作用が始まるのである。